
Б.ЛЬЮИН
Гены
Перевод с английского канд.биол.наук А.Л.Гинцбурга, д-ра биол.наук Т.С.Ильиной, канд. биол. наук Э.С.Каляевой и канд.биол.наук Т. Ю. Переслени
под редакцией чл.-корр. АН СССР Г.П.Георгиева
Москва «Мир» - 1987
Часть VIII
Упаковка ДНК
Глава 30.
Нуклеосомы в активном хроматине.
Появление модели, описывающей хроматин как нить двуспиральной ДНК, закрученной вокруг серии нуклеосом, явилось первой критической вехой в выяснении способа организации генетического материала в ядре. Это несколько статический взгляд на строение отдельной субъединицы и (в некоторой степени) на его взаимоотношение со следующей субъединицей. Нам еще предстоит рассмотреть вопрос о том, происходит ли образование нуклеосом на этой нити случайным образом или это определяется специфической последовательностью ДНК.
Организация хромосом в действительности должна быть достаточно гибкой, для того чтобы удовлетворять различным требованиям, предъявляемым к структуре и функциям хроматина. Например, наличие нуклеосом характерно как для эухроматина, так и для гетерохроматина. Можно ли идентифицировать наборы нуклеосом, различные свойства которых объясняли бы структурные и функциональные свойства определенных участков хромосомы? Являются ли нуклеосомы единственным типом структуры, построенной из нити двухцепочечной ДНК и белка, или же для некоторых участков характерны другие структуры?
До сих пор мы рассматривали структурные изменения в хроматине, главным образом исходя из того факта, что в митотических хромосомах эухроматин обязательно должен принимать более плотноупакованное состояние. Это периодическое изменение охватывает весь эухроматин более или менее одновременно. Вероятнее всего, что этот процесс контролируется изменениями в белках, широко распределенных по всему хроматину. Изменения противоположного типа происходят при событиях двух типов, имеющих место только в таких топологических условиях, когда структура находится в растянутом состоянии. Это репликация и транскрипция.
В растущей клетке во время интерфазы весь хроматин должен удвоиться. Репликация происходит как серия индивидуальных событий в небольших участках (репликонах). При этом удваиваются соответствующие участки двухцепочечной ДНК, каждый из которых связан с набором гистоновых октамеров. Какие события происходят при удвоении нуклеосомной частицы, пока еще не установлено (гл. 29), однако разделение цепей родительской ДНК, по-видимому, должно неизбежно нарушать структуру, по крайней мере хроматиновых нитей размером 30 нм, а, возможно, также и нитей размером 10 нм.
Было бы интересно установить протяженность такого нарушения. Происходит ли оно только поблизости от точки синтеза ДНК или затрагивает и более удаленные участки? Существуют ли заметные структурные различия между участками, которые уже реплицированы, и теми, которым это еще предстоит? Быстротечность репликационного события значительно осложняет анализ структуры отдельного участка в момент его репликации.
При транскрипции также происходит раскручивание ДНК, и, вероятно, поэтому требуется расплетение нити в ограниченном участке хроматина. Нетрудно догадаться, что для осуществления этого процесса необходимо некоторое пространство. Особенности политенных хромосом и хромосом типа «ламповых щеток», описанные в гл. 28, дают представление о том, что более пространная структурная организация может быть связана с экспрессией гена. Хотелось бы выяснить, какие структурные изменения происходят при транскрипции гена. Сохраняет ли он нуклеосомную структуру, и если да, то что происходит с нуклеосомой, когда РНК-полимераза транскрибирует ее ДНК? Затрагивают ли общие структурные изменения активной единицы транскрипции только участок, связанный с РНК-полимеразой, или и другие последовательности, расположенные за пределами этого участка? Чем определяется исходная чувствительность промотора к ферменту?
Можно ли идентифицировать серии нуклеосом, различные свойства которых объясняли бы структуру или функцию определенных участков? И являются ли нуклеосомы единственным типом ДНК-белковой структуры в двухцепочечной нити или существуют другие структуры, характерные для определенных участков?
Как ни важны эти вопросы, на самом деле они служат лишь как бы введением в основной вопрос, связанный с экспрессией генов. Что изменяет состояние гена, делая его способным к транскрипции в нужное время и в нужном месте? Из этого вопроса вытекает второй вопрос: возможно ли выключение гена, и если да, то каким образом?
Мы знаем, что in vitro можно реконструировать нуклеосомы безотносительно к последовательности ДНК. Однако это не исключает того, что in vivo их образование может контролироваться последовательностью нуклеотидов. Находится ли специфическая последовательность ДНК всегда в определенном положении по отношению к топографии нуклеосомы in vivo? Или же нуклеосомы расположены на ДНК случайным образом так, что специфическая последовательность в одной копии генома располагается в участке минимальной нуклеосомы, а в другой приходится на межнуклеосомный промежуток?
Чтобы исследовать этот вопрос, нужно взять ДНК с известной последовательностью или, что более точно, нужно установить положение определенной точки в ДНК относительно нуклеосомы. На рис. 30.1 изображена принципиальная схема такого эксперимента.
Предположим, что определенная последовательность ДНК организована в нуклеосомы только одной конфигурации так, что каждый участок в ДНК локализован в нуклеосоме всегда в одном и том же положении. Это называют фазированием нуклеосом. В серии фазированных нуклеосом линкерные области ДНК заключают в себе уникальные сайты.
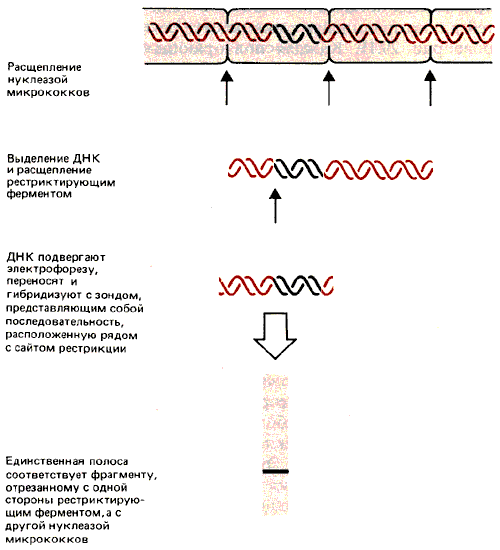
Рис. 30.1. Благодаря нуклеосомному фазированию сайты рестрикции попадают в уникальные положения линкерных участков, которые разрезаются нуклеазой микрококков.
Рассмотрим последовательность только для одной нуклеосомы. При расщеплении нуклеазой микрококков образуется мономерный фрагмент, состоящий из специфической последовательности. Если выделить ДНК и расщепить ее рестриктирующим ферментом, для которого имеется только один сайт рестрикции на этом фрагменте, то ДНК будет разрезана только в одной точке. При этом образуются два фрагмента, каждый с уникальным размером. Продукты двойного расщепления нуклеазой микрококков и рестриктирующим ферментом разделяют с помощью электрофореза в геле. Для идентификации фрагментов, образованных в результате двойного расщепления, используют специальный зонд, представляющий собой последовательность ДНК, непосредственно примыкающую к сайту рестрикции (с одной стороны). Этот метод называют непрямым концевым мечением (не совсем соответствующее название).
Иначе говоря, идентификация одной четкой полосы показывает, что положение сайта рестрикции однозначно определено по отношению к концу нуклеосомной ДНК (который соответствует разрезу нуклеазой микрококков). Таким образом, нуклеосома обладает уникальной последовательностью ДНК.
Что происходит в том случае, если нуклеосома не занимает одно-единственное положение? Эта возможность рассматривается на рис. 30.2, где показано пять возможных способов локализации нуклеосомы на одной последовательности ДНК. Но в действительности их может быть столько, сколько пар оснований находится в повторяющейся единице. В этом случае в каждой копии генома линкерная ДНК состоит из, разных последовательностей ДНК. Сайты рестрикции каждый раз лежат в разном положении. В действительности они могут находиться во всех возможных положениях по отношению к концам мономерной нуклеосомной ДНК.
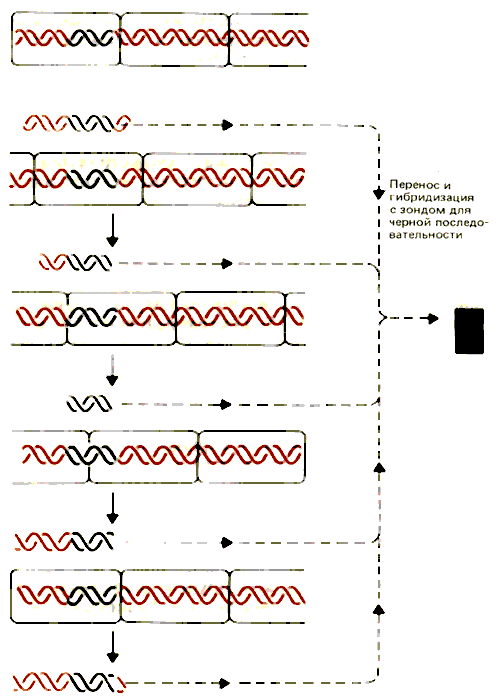
Рис. 30.2. При отсутствии нуклеосомного фазирования сайт рестрикции попадает во все возможные точки локализации в разных копиях генома. На рисунке показаны результаты образования разрывов справа от черной последовательности и в местах соединения нуклеосом.
Отдельный мономерный фрагмент, полученный после расщепления нуклеазой микрококков, может быть представлен разнообразием последовательностей; под действием рестриктирующего фермента этот фрагмент распадается, образуя непрерывную серию более мелких фрагментов. Если мы примем, что наименьший фрагмент, который можно идентифицировать методом гибридизации, содержит 20 пар нуклеотидов, то в описанном выше опыте мы получим размазанное пятно, содержащее фрагменты от 20 п. н. до полной длины мономерной ДНК.
При анализе реальных последовательностей интерпретация результатов оказывается несколько сложнее. В случае больших геномов невозможно достаточно точно идентифицировать один уникальный фрагмент. А нам нужно узнать, фазирована ли нуклеосома не только в одной короткой последовательности, а на протяжении некоторого важного участка. Так, при попытках исследовать фазирование нуклеосом часто используют тандемно повторяющиеся последовательности. При этом подходе нужный фрагмент эффективно амплифицируется. В таком случае изучение отдельного фрагмента позволяет установить, фазирована ли данная последовательность в каждой из повторяющихся единиц генома.
Такие зонды были использованы для изучения фазирования сателлитных ДНК, тРНК, 5S-ДНК, а также гистоновых генов. В этих случаях фазирование нуклеосом может иметь место только при условии простых взаимоотношений между длиной нуклеосомного повтора и длиной тандемно повторяющейся единицы.
В большинстве случаев экспериментальные данные не получаются такими четкими, как в опыте, показанном на рис. 30.1 для однозначного расположения нуклеосом. Но иногда они достаточно сильно отличаются от широких полос или размазанных пятен, предполагаемых для случайной локализации. Из этих экспериментов действительно следует, что число сайтов разрезания нуклеазой микрококков ограничено немногими положениями по отношению к конкретным сайтам рестрикции. Следовательно, можно предположить, что образование нуклеосом ограничено таким способом, который позволяет им находиться только в немногих (2-4) альтернативных фазах.
Интересная ситуация была обнаружена в некоторых генах тРНК у Xenopus laevis. В хроматине эритроцитов, где гены не экспрессируются, ДНК организована в нуклеосомы с длиной повтора 198 п.н. Большинство нуклеосом находится в одной фазе на протяжении по крайней мере 3 т.п.н. (внутри этого участка может быть отрезок в 250 п. н. без нуклеосом). Иная картина наблюдается в хроматине клеток печени и почек, в которых происходит экспрессия генов тРНК. Длина нуклеосомного повтора в этом случае составляет всего 185 п.н., и нуклеосомы не фазированы. Из этого следует, что размер нуклеосомного повтора и локализация нуклеосом могут, очевидно, изменяться в зависимости от обстоятельств.
Фазирование нуклеосом может осуществляться одним из двух способов. Один из них заключается в том, что каждая нуклеосома располагается специфически на определенной последовательности ДНК. Это несколько противоречит представлению о том, что нуклеосомная субъединица может образоваться в результате соединения любой последовательности ДНК с гистоновым октамером. Второй возможный способ связан с существованием некой специфической последовательности, которая предпочтительно участвует в образовании первой нуклео-сомы на данном участке, а затем начинается последующее образование нуклеосом с определенным размером нуклеосомного повтора. (Если в конструкции нуклеосом существует некоторое разнообразие - например, если длина линкерного участка может варьировать, скажем, на 10 п.н., - место специфической локализации будет постоянно смещаться по мере удаления от первой фиксированной нуклеосомы.) Стартовую точку образования нуклеосом можно определить путем связывания негистоновых белков со специфическим сайтом ДНК.
Несмотря на то что фазирование возле фиксированных сайтов может быть обусловлено пограничным эффектом, могут также существовать фазированные ряды нуклеосом. В качестве примера назовем a-сателлитный хроматин африканской зеленой мартышки. Эта ДНК состоит из тандемно повторяющейся последовательности в 172 п.н. Длина повтора в нуклеосомах такая же, так что одна нуклеосома приходится на один сателлитный повтор.
Широко распространенный негистоновый белок, называемый a-белком, связывается преимущественно с a-ДНК, узнавая два типа коротких А—Т-богатых последовательностей. Расположение этих последовательностей в повторяющейся единице сателлитной ДНК показано на рис. 29.19. Каждая повторяющаяся единица ДНК содержит одну копию первой последовательности (сайт I) и две копии второй последовательности (сайты II и III), находящиеся в противоположной ориентации. Инвертированные последовательности отстоят на 145 п.н.: расстояние, равное длине ДНК, обмотанной вокруг гистоновой сердцевины. Другой сайт расположен посередине между ними.
Нуклеосомы a-сателлитной ДНК фазированы таким образом, что положение сайтов II и III приходится на концы ДНК минимальной нуклеосомы. Поскольку ДНК закручена вокруг гистонового октамера, сайт I находится в непосредственной близости от них. Таким образом, кластер сайтов, связывающих a-белок, находится на одном и том же участке поверхности нуклеосомы.
Исходя из локализации этих сайтов связывания можно предположить, что a-белок отвечает за фазирование нуклеосом. Связываясь с регулярно расположенными сериями сайтов в ДНК, a-белок может обеспечивать сборку гистонов в октамеры нуклеосом, ДНК которых находится в определенной фазе. Этот механизм может использоваться для фазирования нуклеосом на протяженном участке, или, действительно, для запуска образования серии нуклеосом, начиная с фиксированного положения.
Значение фазирования нуклеосом, даже если считать его доказанным в некоторых случаях, неясно. Одна из возможных причин кажущегося фазирования заключается в том, что существуют области, в которых нет нуклеосом. Такие области могут быть связаны с контролем экспрессии генов или же с образованием структур более высокого уровня организации хроматина. Вполне возможно, что область, лишенная нуклеосом, служит барьером, ограничивающим возможность образования следующей нуклеосомы в определенных положениях. В этом случае статистическое распределение нуклеосом будет таким же, как при фазировании, хотя отдельные места их расположения не обязательно должны быть фиксированы в каждой индивидуальной копии генома.
В процессе обсуждения экспериментальных данных мы говорили о нуклеазе микрококков как о ферменте, который расщепляет ДНК в незащищенных линкерных участках независимо от их нуклеотидной последовательности. Вначале так действительно и считали. Однако с тех пор было выяснено, что фермент обладает некоторой специфичностью (склонен выбирать определенные А—Т-богатые последовательности). Таким образом, мы не можем считать, что наличие специфической полосы при использовании непрямого концевого мечения указывает расстояние от места рестрикционного расщепления до линкерного участка. На деле данная полоса может отражать расстояние от места рестрикционного расщепления до сайта предпочтительного расщепления нуклеазой микрококков!
Возможность такой ситуации выяснена с помощью контрольного эксперимента, в котором очищенную ДНК обрабатывали точно так же, как и хроматин. Если в определенном участке имеются места предпочтительного действия для нуклеазы микрококков, то должны образовываться специфические полосы. Затем полученную картину расположения полос сравнивали с той, которая получалась при обработке хроматина.
Если расположение нуклеосом на ДНК происходит случайным образом, то все сайты, чувствительные к нуклеазе микрококков, рано или поздно окажутся в линкерной области, став доступными для действия фермента. Картина расположения полос при расщеплении хроматина и ДНК будет одинаковой. Но, если нуклеосомы лежат в упорядоченных местах (фазированы), некоторые сайты, чувствительные к нуклеазе микрококков, будут вне пределов досягаемости, так как окажутся в пределах минимальной нуклеосомы. Тогда отдельные полосы, обнаруживаемые при электрофорезе расщепленной ДНК, будут отсутствовать в электрофореграммах расщепленного хроматина. Если же при образовании нуклеосом возникают новые чувствительные сайты, то в электрофореграммах расщепленного хроматина можно будет обнаружить новые полосы. Таким образом, различиев расположении полос при расщеплении контрольной ДНК и хроматина доказывает существование фазирования нуклеосом. Такие эксперименты действительно были выполнены.
Эти результаты проливают некоторый свет на природу межнуклеосомного сайта, разрезаемого нуклеазой микрококков. Вероятно, фермент разрезает линкерную ДНК не в наиболее открытой точке, а в предпочтительном сайте, ближайшем к этому положению (если такой есть). Поскольку положение таких сайтов может быть различным, ширина полос увеличивается. Способность сайтов предпочтительного расщепления привлекать к себе фермент, возможно, увеличивает количество положений в линкерной ДНК, наиболее доступных для нуклеазы микрококков.
В процессе транскрипции локально расплетенный участок, образованный РНК-полимеразой, перемещается вдоль ДНК (как это описано в гл. 10). При этом обе комплементарные цепи ДНК непосредственно связаны с ферментом или даже окружены им, как это изображено на рис. 10.3. Примерно 50 п.н. ДНК действительно связаны с ферментом настолько прочно, что даже защищены от действия нуклеаз. Поскольку ДНК должна быть расплетена, то кажется маловероятным, чтобы участок, связанный с РНК-полимеразой, мог оставаться на поверхности нуклеосом. Однако о стереохимии работы РНК-полимеразы (особенно у эукариот) известно мало. Поэтому можно предполагать, что фермент способен использовать одну цепь ДНК в качестве затравки, тогда как другая цепь остается связанной с гистонами.
Механизм, с помощью которого ДНК расплетается, образуя матричную цепь для РНК-полимеразы, неясен. Обычно считают, что в этом процессе участвует что-то вроде шарнира, благодаря которому одна цепь ДНК может свободно вращаться относительно другой. Проблема раскручивания еще более усложняется, если ДНК во время транскрипции неподвижно закреплена на нуклеосоме.
При рассмотрении этих вопросов следует помнить об относительных размерах РНК-полимеразы и нуклеосомы. Эукариотические ферменты - это большие белки, обычно более 500 000 дальтон. Сравним это с молекулярной массой нуклеосомы, составляющей 264 000. На рис. 30.3 показан момент приближения РНК-полимеразы к нуклеосомной ДНК. Даже не зная в деталях механизма их взаимодействия, нетрудно представить, что при этом происходит сближение двух сравнимых по размерам тел. Кажется несомненным, что в процессе их взаимодействия должны происходить структурные изменения.
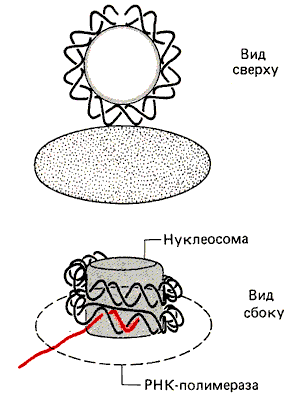
Рис. 30.3. РНК-полимераза сравнима по размеру с нуклеосомой и может испытывать затруднения, продвигаясь по ДНК вокруг нуклеосомы.
Нуклеосомная ДНК относительно нечувствительна к нуклеазе микрококков. Даже в изолированных частицах минимальной нуклеосомы только часть связей в ДНК оказывается чувствительной к ДНКазе I, делающей одноцепочечные разрывы (гл. 29). Напомним, что каждая нуклеосома существует не изолированно, а по соседству с другими, и рассмотрим два оборота ДНК, закрученные вокруг нуклеосомы. Все это выдвигает на первый план вопрос о том, имеет ли РНК-полимераза достаточный доступ к ДНК, если нуклеиновая кислота как обычно закручена вокруг нуклеосомы. Трудно себе представить, что в процессе транскрипции полимераза может следовать по ДНК вокруг нуклеосомы.
Таким образом, первый вопрос, касающийся структуры активных генов, заключается в том, организована ли транскрибируемая ДНК в виде нуклеосом.
Гены, кодирующие рРНК, можно исследовать под электронным микроскопом. Структура ДНК при этом плохо видна из-за плотного расположения молекул РНК-полимеразы. Это отчетливо видно на рис. 23.4 и на другом примере, показанном на рис. 30.4. Плотность упаковки ДНК можно подсчитать, разделив известную длину единицы транскрипции, которую измеряют по оси транскрипционной матрицы. Она равна примерно 1,2. Таким образом, ДНК почти полностью вытянута и не может быть организована в нуклеосомы.
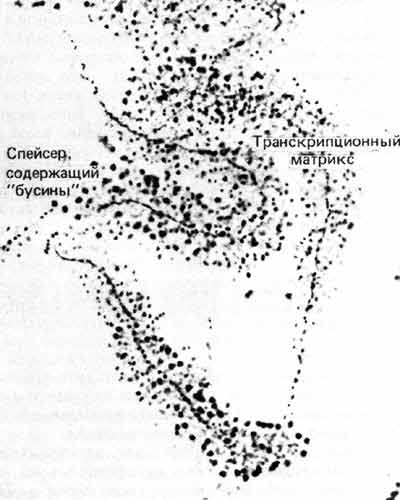
Рис. 30.4. Вытянутая вдоль оси единица транскрипции рДНК переходит в несколько менее вытянутый нетранскрибируемый спейсер. (Фотография любезно предоставлена Charles Laird.)
Нетранскрибируемые спейсеры между транскрипционными матрицами также почти полностью вытянуты; их плотность упаковки составляет около 1,4. При соблюдении в процессе приготовления препаратов определенных условий в спейсерах обнаруживают «бусины», которые, возможно, являются нуклеосомами. Если это так, то должна быть и свободная спейсерная ДНК, которая их соединяет. При других условиях получения препаратов спейсеры состоят из свободной ДНК. Все это свидетельствует о том, что состояние ДНК в интенсивно транскрибируемых тандемных генах рРНК сильно отличается от компактной организации, которая видна даже в отдельной цепочке соседних нуклеосом в хроматиновой нити размером 10 нм (плотность упаковки которых равна ~ 6).
С другой стороны, из инфицированных клеток могут быть экстрагированы транскрипционные комплексы мини-хромосом SV40. Они содержат обычный комплект гистонов и имеют структуру бусинок. Можно видеть цепи РНК, тянущиеся из мини-хромосом, как это показано на рис. 30.5. Из этого следует, что на ДНК вируса SV40 может происходить транскрипция, не нарушая нуклеосомной организации. Мини-хромосома SV40 транскрибируется менее интенсивно, чем гены рРНК. Более редко транскрибируемые клеточные гены также можно наблюдать в виде частично вытянутых структур, в которых содержится меньше нуклеосом, чем в нетранскрибируемых областях.
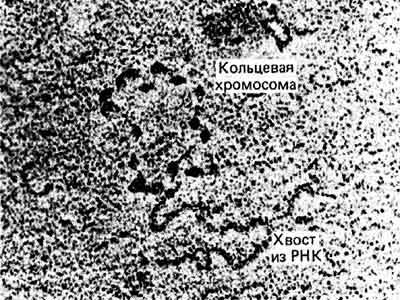
Рис. 30.5. Мини-хромосома вируса SV40 может транскрибироваться. (Фотография любезно предоставлена Pierre Chambon.)
Другой подход к изучению этого вопроса заключается в расщеплении хроматина нуклеазой микрококков с последующим использованием зонда для определенного гена (или генов), чтобы установить наличие соответствующих фрагментов в обычной лестнице с шагом в 200 п.н. В таких экспериментах гены рРНК могут обнаруживаться во фракции нуклеосом. Однако всегда остается возможность, что эти определенные фрагменты происходят из некоторых нетранскрибируемых участков, тандемно входящих в исследуемый набор фрагментов.
Аналогичная проблема возникает при исследовании уникальных генов. В случае генов, которые транскрибируются не непрерывно, проблема заключается в том, что в клеточной популяции в каждый данный момент транскрибируются только некоторые гены. Для того чтобы преодолеть эту трудность, сравнивают сумму гибридизующихся с зондом последовательностей в мономерных фрагментах и в целой ДНК. При использовании зондов, соответствующих индивидуальным генам или популяциям мРНК (или в этом случае сателлитной ДНК), одни и те же результаты получают при гибридизации с нуклеосомными фрагментами и с целой ДНК.
Из этих экспериментов можно сделать ограниченные, но важные выводы. В генах, которые в данный момент транскрибируются, нуклеосомы расположены с такой же частотой, что и в нетранскрибируемых последовательностях. Таким образом, для транскрипции гены не должны обязательно принимать другую форму организации. Но, поскольку часть гена, связанная с молекулами РНК-полимеразы, может быть довольна мала, мы не можем судить о том, что происходит в местах, непосредственно связанных с ферментом. Возможно, что нуклеосомы там сохраняются. Но, может быть, в местах следования РНК-полимеразы нуклеосомная структура временно исчезает, а затем сразу восстанавливается.
Эти эксперименты показывают также, что активные гены быстрее расщепляются до мономерных фрагментов, чем неактивные последовательности. Это может свидетельствовать о том, что, несмотря на нуклеосомную организацию, структура активных генов менее защищена.
На примере некоторых генов теплового шока у D. melanogaster можно проиллюстрировать, что во время транскрипции в структуре нитей хроматина происходят определенные изменения. В период, предшествующий тепловому шоку, эти гены транскрибируются не слишком часто, а обработка нуклеазой микрококков приводит к появлению типичной лестницы (указывающей на нуклеосомную организацию соответствующих районов). После теплового шока они активируются и затем начинают интенсивно транскрибироваться. Как видно из рис. 30.6, лестница в результате оказывается довольно смазанной, что указывает на изменение нуклеосомной организации.
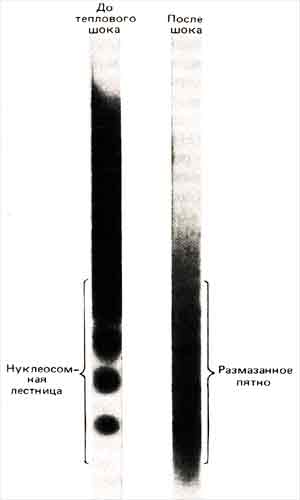
Рис. 30.6. До активации генов теплового шока в результате обработки нуклеазой микрококков возникает отчетливая лестница, которая становится смазанной после начала интенсивной транскрипции. (Фотография любезно предо ставлена Sarah Elgin.)
Природа такого изменения непонятна. Такие воздействия, как разрезание хроматина под действием сил сдвига, могут уничтожить характерную реакцию на ну-клеазу микрококков даже при сохранении нуклеосомной структуры. Таким образом, мы не можем сказать, исчезает ли лестница из-за того, что присутствие РНК-поли-меразы (или других белков) затемняет картину, поскольку при этом нарушается высокая упорядоченность структуры, или оттого, что нуклеосомы видоизменяются или даже совсем исчезают.
Очевидно, что при интенсивной транскрипции гена происходят существенные структурные изменения. В случае генов рРНК это проявляется в исчезновении нуклеосом. Но, возможно, это исключительный случай. С присутствием нуклеосом в умеренно транскрибируемых генах вполне согласуется предположение о том, что РНК-полимераза нарушает нуклеосомную структуру в точке транскрипции, но сразу после этого гистоновый октамер снова занимает свое место, если только другая молекула РНК-полимеразы не помешает ему это сделать.
Важно дифференцировать две возможные причины изменения структуры хроматина в транскрибируемых участках.
Поскольку в любой клетке транскрибируется только характерное меньшинство последовательностей ДНК, должны существовать отличительные черты, по крайней мере у промоторов (а возможно, и по всей длине), этих единиц транскрипции. Поэтому первым изменением должно быть некоторое событие, которое указывает аппарату транскрипции, что локус готов к экспрессии.
В транскрибируемом гене должно произойти некоторое изменение структуры, хотя бы только в результате передвижения РНК-полимеразы по ДНК. Таким образом, структурные изменения могут быть следствием акта транскрипции, а не его причиной. Оценивая свойства транскрибируемых локусов, нам нужно определить, какие из его признаков существовали до транскрипции в качестве ее предпосылки, а какие были индуцированы потом как результат событий, вовлеченных в синтез РНК. При расщеплении хроматина ДНКазой I он деградирует в конце концов до кислоторастворимого материала (очень мелких фрагментов ДНК). За общим ходом реакции можно проследить, определяя долю ДНК, перешедшей в кислоторастворимую фракцию. За судьбой же отдельного гена можно проследить, исследуя количество нерасщепившейся ДНК по ее способности вступать в реакцию со специфическим зондом (для этого обычно используются метод рестрикционного расщепления, блоттинг и гибридизацию). Схема такого опыта приведена на рис. 30.7. Основной подход заключается в том, что потеря определенной полосы свидетельствует о том, что именно этот участок переварен ферментом.
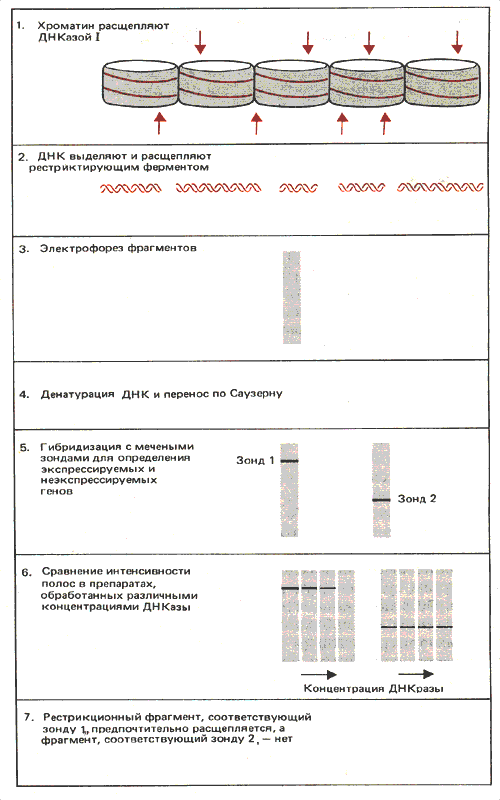
Рис. 30.7. Чувствительность к ДНКазе I можно измерить, определяя скорость исчезновения материала, гибридизующегося с данным зондом.
Оказывается, что расщепление до кислоторастворимого состояния только 10% общей ДНК приводит к исчезновению более 50% ДНК активных генов. Следовательно, можно предположить, что при таком расщеплении происходит преимущественная деградация активных генов. Исчезновение активных генов можно подтвердить прямым сравнением судьбы двух генов, активного и неактивного. На рис. 30.8 показано, что происходит с генами b-глобина и с геном овальбумина в хроматине, выделенном из куриных эритроцитов (в этом хроматине гены глобинов экспрессируются, а ген овальбумина неактивен). Рестрикционные фрагменты, соответствующие генам b-глобина, быстро теряются, тогда как фрагменты, представляющие ген овальбумина, расщепляются незначительно. (Ген овальбумина фактически деградирует с той же скоростью, что и вся ДНК, хотя это и не следует из показанного на рисунке анализа ранних стадий реакции методом блотт-гибридизации. Противоположная картина наблюдается в ткани яйцевода, в которой преимущественно деградирует ген овальбумина, тогда как глобиновые гены устойчивы, как весь остальной хроматин. Это коррелирует с активностью овальбумина и неактивностью глобина.
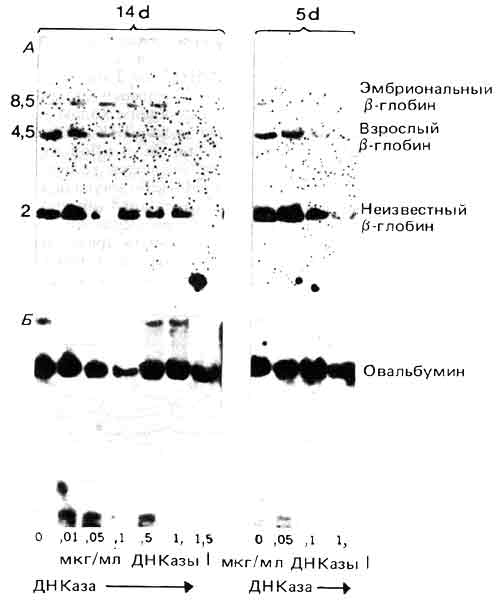
Рис. 30.8. В хроматине 14-дневных клеток эритроидного ряда b-глобиновый ген взрослого типа высокочувствителен к ДНКазе I, ген эмбрионального b-глобина чувствителен, а ген овальбумина нечувствителен. В 5-дневных клетках ген эмбрионального глобина высокочувствителен, ген глобина взрослого типа чувствителен, а ген овальбумина нечувствителен. Изменения в чувствительности генов глобинов эмбрионального и взрослого типов обсуждаются ниже в тексте. (Данные любезно предоставлены Harold Weintraub.)
Таким образом, большая часть хроматина относительно устойчива к ДНКазе I и содержит неэкспрессируемые гены (так же, как и другие последовательности). Гены овальбумина и глобинов становятся относительно чувствительными к ферменту специфически в тех тканях, в которых они экспрессируются.
Характерна ли преимущественная чувствительность только для достаточно активных генов, таких, как гены глобинов и овальбумина, или для всех активных генов? Эксперименты, в которых использовали зонды для кДНК, соответствующие популяции всей клеточной мРНК, свидетельствуют о том, что все активные гены предпочтительно чувствительны к ДНКазе I независимо от того, кодируют ли они часто или редко встречающиеся мРНК. (Однако они могут различаться по степени чувствительности.) Поскольку редко экспрессируемые гены в любой момент времени, вероятно, содержат небольшое число активно транскрибирующей РНК-полимеразы, то очевидно, что чувствительность к ДНКазе I не является результатом акта транскрипции, а присуща готовым к транскрипции генам.
Как велика область, преимущественно чувствительная к ДНКазе I? Это можно определить, используя серию зондов, соответствующих фланкирующим участкам, а также самой единице транскрипции. Оказывается, что чувствительная область всегда захватывает достаточно протяженные участки по обе стороны от единицы транскрипции. Поэтому было высказано предположение, что чувствительность к ДНКазе характерна для хромосомного домена, т.е. области, включающей в себя по крайней мере одну активную единицу транскрипции, но при этом присущее ей структурное изменение простирается за пределы этой единицы. (Заметим, что при использовании здесь термина «домен» не подразумевается какой-либо связи со структурными доменами, соответствующими петлям хроматина или хромосом.)
При исследовании вопроса о том, в равной ли мере сохраняется чувствительность к ДНКазе на протяжении всего домена, были получены некоторые расхождения в результатах отдельных опытов. В кластере р-глоби-новых генов цыпленка чувствительный домен тянется на 6-7 т.п.н. с 5'-конца кластера и по крайней мере на 8 т.п.н. с З'-конца. Внутри самого кластера генов транскрибируемая область более чувствительна к ДНКазе I, чем ее нетранскрибируемые фланкирующие участки (которые называют участками «промежуточной» чувствительности.) Сходным образом ген овальбумина и родственные гены X и Y могут находиться в домене, чувствительном к ДНКазе, который занимает около 100 т.п.н. Но в этом случае, по-видимому, нет каких-либо различий в чувствительности между кодирующей и некодирующей ДНК внутри домена.
Наиболее существенной частью в определении домена является концепция о том, что область, чувствительная к ДНКазе I, захватывает по крайней мере длину единицы транскрипции. Часто мы думаем, что регуляция заключается в ряде событий, возникающих в дискретной последовательности ДНК, - например, в способности инициировать транскрипцию на промоторе. Даже если это и так, такая регуляция должна определяться или сопровождаться структурными изменениями более широкого масштаба. В этом может быть различие между эукариотами и прокариотами.
Чем обусловлено состояние чувствительности к ДНКазе? Чтобы выявить различия в чувствительности, которые могут быть связаны с изменениями в структуре хроматина, следует обратиться к негистоновым белкам. Чувствительный хроматин отличается по поведению некоторых HMG-белков. Два негистоновых белка, HMG14 и HMG17, преимущественно высвобождаются из хроматина при расщеплении ДНКазой I. (HMG - от англ, high mobility group, т.е. высокомобильная группа маленьких негистоновых белков. Эти белки экстрагируются из хроматина с помощью 0,35М NaCl, что указывает на их относительно непрочное связывание.)
После экстракции этих белков глобиновый ген в хроматине эритроцитов не проявляет предпочтительной чувствительности к ДНКазе I. Однако чувствительность восстанавливается при обратном добавлении этих белков к хроматину, из которого они были высолены. Эти белки не придают предпочтительной чувствительности глобиновым генам, если их добавить к хроматину мозга, обработанному таким же способом. Отсюда следует, что данный эффект зависит не только от HMG-белков. Глобиновые гены эритроцитов и мозга могут, по-видимому, различаться по некоторому фактору, сохраняющемуся в хроматине после солевой экстракции. Именно это различие позволяет хроматину эритроцитов связывать белки HMG14 и HMG17, образуя структуру, обусловливающую чувствительность глобиновых генов к ДНКазе.
Один из этих двух белков (либо HMG14, либо HMG17) эффективен сам по себе. Добавления примерно одного моля HMG достаточно для того, чтобы придать чувствительность каждой из 10-20 нуклеосом, выделенных из общей массы хроматина. Из этого следует, что HMG может выбирать соответствующую мишень в препарате хроматина. Такое же соотношение остается и для активно транскрибируемых генов, таких, как ген глобина, и для редко транскрибируемых.
Возникает ли чувствительность к ДНКазе на уровне индивидуальной нуклеосомы? Мономеры, выделенные в результате обработки нуклеазой микрококков, проявляют точно ту же чувствительность, что и целые ядра или хроматин. При удалении белков HMG14 и HMG17 этот эффект исчезает и снова появляется при их добавлении. Такие же результаты наблюдают при исследовании частиц минимальной нуклеосомы. Из этого следует, что минимальные нуклеосомы из активных генов должны иметь некие характерные признаки, позволяющие им связывать белки HMG14 и HMG17. Однако попытки идентифицировать эту характерную особенность пока остались без успеха. Отметим, что в этой работе было отчетливо показано, что ген глобина сохраняет во время транскрипции нуклеосомное строение.
Промежуточный уровень чувствительности к ДНКазе, характерный для участков, фланкирующих транскрибируемые гены глобинов у кур, теряется в результате воздействий, нарушающих высокоупорядоченную структуру хроматина, и не сохраняется в отдельных нуклеосомах. Его нельзя восстановить добавлением белков HMG14 и HMG17. При иммобилизации HMG14 и HMG17 на колонках их можно использовать для выделения подвергнутых солевой обработке нуклеосом, обладающих реакционной способностью. В этих экспериментах удалось выделить только высокочувствительные транскрибируемые области.
Из этих опытов следует, что чувствительность к ДНКазе может быть обусловлена образованием высокочувствительного участка, охватывающего с обеих сторон последовательность, способную транскрибироваться. Протяженность этого участка с каждой стороны составляет, очевидно, менее 1 т.п.н. Соседние участки, на которые распространяются структурные изменения, могут проявлять промежуточную чувствительность (хотя область чувствительности достаточно велика относительно длины самого транскрибируемого участка).
Каковы временные отношения между приобретением состояния чувствительности к ДНКазе и началом процесса транскрипции? Хотя мы и располагаем некоторыми данными, полученными на системе глобина курицы, их нельзя четко интерпретировать. Клетки эритроидного ряда 5-дневного эмбриона продуцируют только эмбриональный глобин, тогда как эритроидные клетки 14-дневного эмбриона производят глобины взрослого типа. Однако в клетках 5-дневных эмбрионов гены глобинов обоего типа (эмбрионального и взрослого) чувствительны к ДНКазе I (хотя, как видно из рис. 30.8, гены эмбрионального глобина более чувствительны). Аналогично в клетках 14-дневных эмбрионов ген взрослого глобина высокочувствителен (более чувствителен, чем в 5-дневных клетках), а ген эмбрионального глобина проявляет промежуточную чувствительность.
Сначала думали, что состояние чувствительности к ДНКазе может отражать активацию генной структуры, происходящую перед началом транскрипции. Тогда чувствительность может служить отличительным признаком генов, потенциально способных к транскрипции, а также уже транскрибируемых генов. С другой стороны, если чувствительность распространяется из максимально чувствительного участка активного гена так, что данный домен простирается до фланкирующей области, чувствительность глобиновых генов взрослого типа в эмбриональных клетках (или наоборот) может свидетельствовать о группировании этих генов в кластеры, а не о функциональном значении. Для того чтобы установить, предшествует ли появление чувствительности началу транскрипции, нужно исследовать изолированный ген, так чтобы не было оснований предполагать наличие эффекта распространения от соседних локусов.
Из двух дальнейших примеров станет очевидным, что состояние чувствительности может сохраняться и после остановки транскрипции. Эритроциты курицы - это зрелые эритроциты, в которых продолжается трансляция глобиновой мРНК, но не происходит транскрипции генов. Однако глобиновые гены остаются в чувствительном состоянии. Удаление экстрогена из курицы приводит к тому, что транскрипция овальбуминового гена прекращается, но кодирующая область остается при этом в активном состоянии. У нас пока нет данных о том, чтобы ранее активный ген превращался в неактивную форму (устойчивую к ДНКазе), например в ходе эмбрионального развития.
Очевидно, что изменение чувствительности к ДНКазе необходимо для осуществления транскрипции, однако оно не является ни ее причиной, ни следствием. Сохранение чувствительного состояния после того, как прекращается транскрипция, показывает, что структура гена может находиться в активном состоянии и в отсутствие активной молекулы РНК-полимеразы. Эти данные наряду с данными о чувствительности редко транскрибируемых генов позволяют предположить, что изменение в структуре не зависит от самого акта транскрипции.
Следовательно, чувствительность к ДНКазе - условие, необходимое для осуществления транскрипции, но отнюдь не достаточное. Хотелось бы получить больше сведений о природе чувствительного домена, особенно о том, как устанавливаются его границы. Следует задать вопрос: чем объясняется необходимость изменения структуры каждой нуклеосомы в единице транскрипции? Ответ, возможно, состоит в том, что такое изменение позволяет РНК-полимеразе передвигаться вдоль матрицы. Можно представить, например, что гистоны могут быть удалены с ДНК только при условии, что нуклеосомы модифицированы.
В соматических клетках взрослого организма каждый гистон имеет инвариантную аминокислотную последовательность. Но все гистоны подвергаются модификации, при которой дополнительные остатки ковалентно присоединяются к свободным группам определенных аминокислот. Эти модификации приводят к уменьшению общего положительного заряда (то есть основности) белковой молекулы. Поэтому немодифицированные формы и формы с различными модификациями можно разделить, например, с помощью гель-электрофореза.
Реакции ацетилирования и метилирования происходят в свободной (e) аминогруппе лизина. Как видно на рис. 30.9, при этом удаляется положительный заряд, находящийся на NH+3-группе. Реакция метилирования происходит также по аргинину и гистидину.
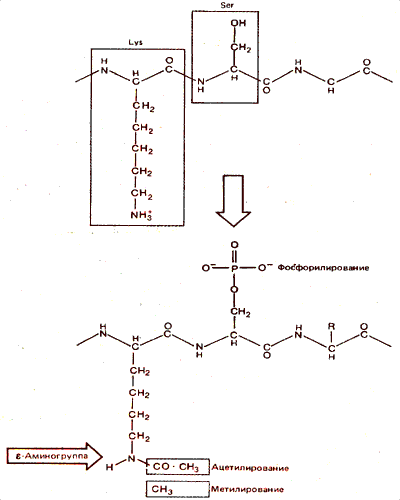
Рис. 30.9. Ацетилирование лизина или фосфорилирование серина уменьшает общий положительный заряд белка.
Фосфорилирование гистонов происходит по гидроксильной группе серина, а также гистидина. При этом вводится отрицательный заряд в виде фосфатной группы (см. рис. 30.9).
Все эти модификации затрагивают внутренние остатки и являются кратковременными. Противоположную картину представляет собой стабильное ацетилирование N-концов некоторых гистонов, происходящее во время их синтеза.
Кратковременные модификации вносятся на одной стадии клеточного цикла и (обычно) снимаются на другой стадии. Поскольку модификации приводят к уменьшению положительного заряда белковой молекулы, их рассматривают как потенциальную возможность изменения функциональных свойств гистонов. В настоящий момент еще не имеется данных, свидетельствующих о связи этих изменений с функциями хроматина, хотя и обнаружены некоторые интересные корреляции.
Цикл ацетилирования и деацетилирования гистонов хорошо изучен на сперме лосося (где вместо гистонов находятся основные белки, называемые протаминами). В этой системе гистоны НЗ и Н4 служат основной мишенью; к каждому из них добавляется до четырех ацетильных групп. Гистоны Н2А и Н2В также ацетилируются, но в меньшей степени. В этом и некоторых других случаях установлены положения, подвергающиеся ацетилированию (или метилированию). У различных органов эти положения неидентичны, хотя они и образуют небольшое число перекрывающихся сайтов.
В синхронизированной культуре клеток и ранее существовавший и новосинтезированный гистоны ацетилируются и метилируются в фазе S. (Это часть клеточного цикла, во время которой происходит репликация ДНК; тогда же синтезируются гистоны.) В более поздней части клеточного цикла модифицированные группы удаляются. Эти события повторяются в каждом клеточном цикле, и их зависимость во времени суммирована на рис. 30.10.
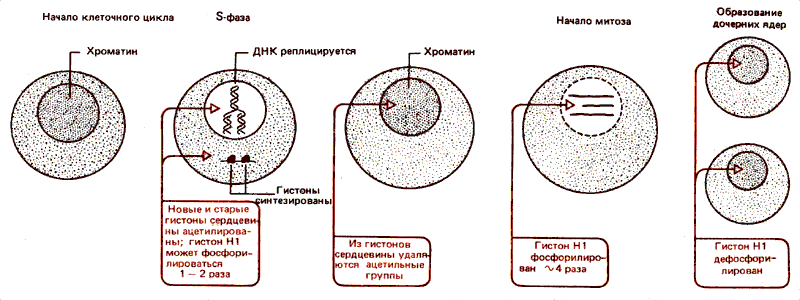
Рис. 30.10. В период синтеза ДНК происходит ацетилирование гистонов сердцевины с последующим деацилированием. Основное фосфорилирование гистона HI происходит в начале митоза; в конце митоза гистон HI дефосфорилируется.
Совпадение времени модификации и репродукции хроматина дает основание думать, что ацетилирование (и метилирование) могут быть связаны со сборкой нуклеосом. Одна из возможностей состоит в том, что уменьшение положительного заряда гистонов может способствовать уменьшению их сродства к ДНК. Это позволило бы лучше контролировать реакцию. Данная идея несколько утратила свою обоснованность ввиду того, что была продемонстрирована способность нуклеосом к реконструкции, по крайней мере in vitro, с немодифицированными гистонами (но см. гл. 29).
Недолговечность ацетилированного состояния оказалась препятствием для его изучения. Однако это препятствие можно преодолеть, добавляя масляную кислоту к клеткам, растущим в культуре. При этом ингибируется фермент гистон-деацетилаза и ацетилированные нуклеосомы накапливаются. Все гистоны сердцевины ацетилированы. При ацетилировании в хроматине происходят изменения, подобные тем, которые наблюдаются при активации гена. Такой хроматин более чувствителен к ДНКазе I и (возможно) к нуклеазе микрококков. Однако каких-либо убедительных корреляций обнаружить не удалось, преимущественного ацетилирования активных генов не обнаружено. Из этого можно сделать вывод, что ацетилирование действительно затрагивает структуру хроматина. Однако значение этого изменения еще неясно.
Цикл фосфорилирования и дефосфорилирования обнаружен у гистона H1, однако по времени он отличается от цикла модификации других гистонов. В культуре клеток млекопитающих одна или две фосфатные группы могут быть Введены в фазе S. Но основное фосфорилирование происходит позднее, когда добавляется еще несколько фосфатных групп, так чтобы общее их число достигло шести. Как показано на рис. 30.10, это происходит в митозе. Все фосфатные группы удаляются в конце процесса деления. Введение некоторых фосфатных групп катализируется ферментом фосфокиназой, активность которой резко возрастает в самом начале митоза. О фосфатазе, под действием которой позднее происходит удаление фосфатных групп, известно немного.
Время основного фосфорилирования гистона H1 навело на мысль о том, что он может участвовать в митотической конденсации хромосом. Это согласуется с данными о необходимости гистона H1 для образования нитей хроматина размером 30 нм (гл. 29). Некоторые температурочувствительные мутанты, дефектные по Н1-фосфорилированию, не способны закончить репликацию ДНК и завершить деление клетки. Но такая корреляция не говорит ничего о том, является ли фосфорилирование причиной или сопутствующим событием митотической конденсации.
Необычная модификация гистона была обнаружена при изучении белка, первоначально обнаруженного в негистоновой фракции хроматина печени крысы. Этот белок, известный сначала как А24, имеет ту же самую С-концевую аминокислотную последовательность, что и Н2А. Однако, как изображено на рис. 30.11, у него две N-концевые последовательности. Одна из них принадлежит гистону Н2А, а другая - белку убиквитину. Название этого белка отражает его повсеместное (ubiquitous) присутствие в клетках - от бактерий до млекопитающих. Конъюгат Н2А-убиквитин теперь обозначают как U H2A.
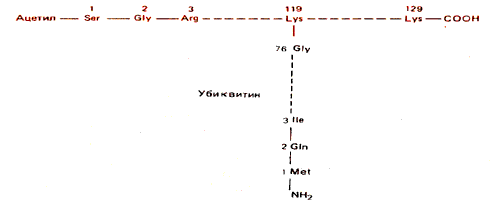
Рис. 30.11. UH2A состоит из убиквитина, связанного с Н2А.
Белок убиквитин состоит из 76 остатков (сравним с гистоном Н2А, содержащим примерно 130 остатков). Изопептидная связь образуется между С-концевым глицином убиквитина и свободной e-NH2-группой лизина в положении 119 гистона Н2А. (Названием изопептидная связь подчеркивается, что данная eNН2-группа - это не обычная аминогруппа, участвующая в образовании пептидной связи.) Убиквитин - это кислый белок, в котором содержание глутаминовой и аспарагиновой кислот таково, что общее отношение основные/кислые аминокислоты во вновь образованном конъюгированном белке оказывается пониженным.
Около 5-15% гистона Н2А может находиться в форме UH2A. Обычно только одна из двух молекул Н2А в гистоновом октамере связана с убиквитином. Следовательно, убиквитин может присутствовать в 10-30% нуклеосом. Он находится, вероятно, на поверхности нуклеосомы. Довольно маленькая доля гистона Н2В также может соединяться с убиквитином.
Нуклеосомы, содержащие гистон Н2А, связанный с убиквитином, можно отделить от немодифицированных нуклеосом с помощью двумерного электрофореза. Сначала нуклеосомы разделяют электрофоретически на одной вертикальной дорожке. Затем электрофорез проводят под углом вправо к первоначальному направлению через всю пластинку геля. Соответствующие фракции отмечены на рис. 30.12. Здесь представлены нуклеосомы, содержащие около 170 п. н. ДНК и H1 (фракция MN2), частицы минимальной нуклеосомы (фракция MN1) и частицы минимальной нуклеосомы, содержащие один или два конъюгата UH2A.

Рис. 30.12. Нуклеосомы, частицы минимальной нуклеосомы и частицы, связанные с убиквитином, можно разделить с помощью двумерного гель-электрофореза.
Образуют ли частицы с UH2A особый класс нуклеосом? Около 20% нуклеосом в хроматине D. melanogaster содержат UH2A. Их ДНК-последовательность можно исследовать методом блотт-гибридизации со специфическими зондами. При использовании зондов, представляющих транскрибируемые гены, около 50% материала оказывается во фракции, содержащей убиквитин. При использовании в качестве зондов сателлитной ДНК во фракцию с убиквитином попадает менее 4% исследованного препарата. Из этого следует, что UH2A отсутствует в гетерохроматине. (Негистоновый белок обнаружен только в нуклеосомах гетерохроматина D. melanogaster.) Конъюгат UH2A имеет тенденцию накапливаться в нуклеосомах транскрибируемых последовательностей.
Функция убиквитина изучена очень плохо. По-видимому, он высвобождается из хроматина в митозе. Этот факт приводит в замешательство, поскольку возникает вопрос: каким образом убиквитинированное состояние определенных участков хроматина наследуется дочерними клетками?
Недавно появились сообщения о возможной функции убиквитина в цитоплазме, где он принимает участие в системе деградации белков. Одна (или более) молекул убиквитина связывается с белком-мишенью в реакции, использующей АТР. Затем белок-мишень деградирует. Следовательно, убиквитин служит маркером, используемым для идентификации субстрата системой деградации. Относится ли это и к событиям в ядре, не известно.
В ДНК животных клеток от 2 до 7% С-остатков метилированы (конкретное значение варьирует в зависимости от вида). Сателлитная ДНК часто бывает метилирована очень сильно. Остальные метальные группы разбросаны по всему геному. Большинство метальных групп найдено в дуплетах CG (CG-GC), и действительно большинство CG-последовательностей может быть метилировано. Эта короткая последовательность представляет собой палиндром, и, как правило, нуклеотид С метилируется в обеих цепях, образуя структуру:
5'-mCpG -3'
3'- GpCm -5'
Дуплет, который в отличие от этого метилирован только по одной из двух цепей, называют полуметилированным.
Распределение метальных групп можно исследовать, используя рестриктирующие ферменты, которые расщепляют сайты-мишени, содержащие CG-дуплеты. На рис. 30.13 сопоставляются два фермента с рестриктирующей активностью. Это изосхизомеры, т.е. ферменты, которые расщепляют в качестве мишени одну и ту же последовательность ДНК, но по-разному реагируют на ее метилирование.
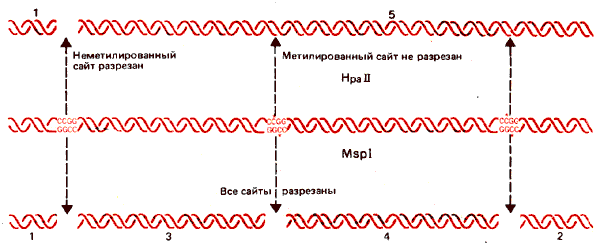
Рис. 30.13. Рестриктирующий фермент MspI разрезает все последовательности CCGG не-зависимо от того, метилированы они или нет, a Hpall разрезает только неметилированные CCGG-тетрамеры.
В этой паре фермент HpaII расщепляет последовательность CCGG (записана последовательность только одной цепи ДНК). Но, если второй нуклеотид С метилирован, фермент перестает узнавать этот сайт. Однако фермент MspI расщепляет тот же самый сайт-мишень независимо от метилирования нуклеотида С. Следовательно, фермент MspI можно использовать для идентификации всех CCGG-последовательностей, a HpaII для того, чтобы определить, метилированы ли эти последовательности. Таким образом, если субстратом служит неметилированная ДНК, оба фермента образуют одни и те же рестрикционные полосы. Но если в ДНК имеются метилированные сайты, то расщепления по этим положениям под действием HpaII происходить не будет. В каждом таком положении один большой фрагмент, образующийся под действием рестриктазы HpaII, будет соответствовать двум фрагментам, образующимся под действием рестриктазы MspI. Такой пример показан на рис. 30.14.
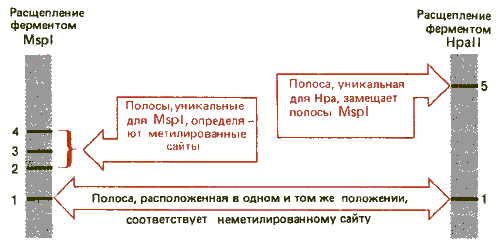
Рис. 30.14. Результаты расщепления ферментами MspI и НраII сравниваются по положению фрагментов в гель-электрофорезе. Число полос соответствует фрагментам, идентифицированным на рис. 30.13.
Инвариантна ли картина метилирования, или она меняется в зависимости от конкретных условий? Отдельные сайты были исследованы в нескольких случаях, в том числе в генах, кодирующих клеточный белок в тандемном кластере рДНК и в последовательности нескольких интегрированных или свободных вирусных геномов. Сайты, идентифицированные с использованием рестриктирующих ферментов, - это лишь некоторые из метилированных последовательностей, но мы полагаем, что их поведение типично для всех таких сайтов.
Полученные результаты во всех случаях были схожи. Некоторые сайты были метилированы во всех исследованных тканях, тогда как некоторые другие во всех тканях оставались неметилированными. Меньшая часть сайтов оказывалась метилированной в таких тканях, в которых данный ген не экспрессировался; в тех же тканях, в которых данный ген экспрессировался, эти сайты были метилированы. Таким образом, можно говорить, что активный ген «недометилирован».
В случае кластера b-глобиновых генов человека наилучшая корреляция наблюдается в генах эмбриона. Большинство (~ 15) идентифицированных сайтов оказывается неметилированными в эритроидной ткани с активной экспрессией, частично метилированными во взрослой эритроидной ткани и метилированными в других тканях. У взрослого организма в тканях с активной экспрессией b-глобиновых генов метилирование некоторых сайтов уменьшено лишь частично. (Под «частичным» метилированием подразумевается, что данный сайт метилирован в одних клетках, но не метилирован в других клетках того же фенотипа.)
В генах рРНК X. laevis большинство CG-сайтов остаются метилированными во всех случаях. Два сайта (расположенные около промотора) деметилируются в процессе эмбрионального развития, когда начинается транскрипция рРНК.
Наряду с изучением состояния метилирования резидентных генов можно сравнивать результаты введения метилированной и неметилированной ДНК в новые клетки-хозяева. Такие эксперименты впервые были выполнены на вирусных генах, а затем на нескольких очищенных клеточных генах. В них обнаружена четкая корреляция: метилированные гены неактивны, а неметилированные гены активны.
Протяженность неметилированных областей in vivo была определена для кластера a-глобинового гена курицы. В клетках эритроидного ряда взрослого организма недометилирование этого гена ограничено сайтами, расположенными на участке протяженностью 500 п.н. в направлении против хода транскрипции (начиная от первого из двух b-глобиновых генов взрослого). Сайты недометилирования присутствуют во всей области, включая спейсер между генами. Область недометилирования достаточно хорошо совпадает с областью максимальной чувствительности к ДНКазе I. Это свидетельствует о том, что недометилирование может быть признаком домена, содержащего транскрибируемый ген или гены.
Интерпретация связи между недометилированием и активацией гена осложняется тем, что в этом процессе участвует меньшинство (иногда совсем незначительное) метилированных сайтов. Однако можно предположить, что критическое значение имеет метилирование специфических сайтов. Например, деметилирование промотора может оказаться достаточным для инициации транскрипции. Возможно также, что уменьшение уровня метилирования является частью некоторого структурного изменения, необходимого для начала процесса транскрипции.
В некоторых генах метилирование, связанное с экспрессией, происходит на 5'-конце. Некоторые гены не метилированы на 5'-конце, но остаются метилированными на З'-конце во время экспрессии. Как и в случае других изменений в хроматине, кажется вероятным, что отсутствие метальных групп связано со способностью к транскрипции, а не с самим актом транскрипции. Насколько важно деметилирование промотора, было бы относительно легко проверить непосредственно, поскольку можно сконструировать in vitro гены, различающиеся только метилированием 5'-конца.
Существуют исключения из описанной нами общей картины. Некоторые гены могут экспрессироваться даже в сильно метилированном состоянии. Ярким исключением является локус гистосовместимости Н2 в линии ранних эмбриональных клеток, который, по-видимому, активируется в результате метилирования. Таким образом, связь между метилированием и экспрессией не универсальна.
Большое внимание уделялось тому, каким образом состояние метилирования может передаваться в ряду клеточных поколений или быть изменено. В ДНК половых клеток, например сперматозоидов, каждый ген находится в неактивном состоянии, т. е. метилированы и постоянные сайты (модифицированные во всех тканях), и вариа-бельные сайты, т.е. те, которые специфически не метилированы в тканях с экспрессируемыми генами. Таким образом, отсутствие определенных метальных групп в активном состоянии представляет собой потерю ранее существовавших модификаций. Мы не знаем, сохраняют ли клеточные гены метальные группы после того, как они перестают экспрессироваться. Критический вопрос, на который хотелось бы получить ответ, заключается в следующем: какие последовательности выбираются в качестве мишени для тканеспецифических изменений в состоянии метилирования?
В основе простой модели, объясняющей воспроизведение метилированных сайтов, лежит предположение, что ДНК-метилаза действует на полуметилированную ДНК. Как видно из рис. 30.15, при репликации полностью метилированного дуплета CG образуются два полуметилированных дочерних дуплекса. Узнавая каждый полуметилированный сайт, фермент может переводить его в обычное, полностью метилированное состояние. Такая модель согласуется с тем фактом, что при введении метилированной ДНК в клетку она продолжает метилироваться на протяжении неопределенного числа циклов репликации с точностью, достигающей 95% на сайт. Если вводится неметилированная ДНК, она не метилируется de novo. Из этого следует, что фермент узнает только полуметилированные сайты. При таком действии фермента состояние дуплета CG/GC метилированное или неметилированное - может наследоваться дочерними клетками.
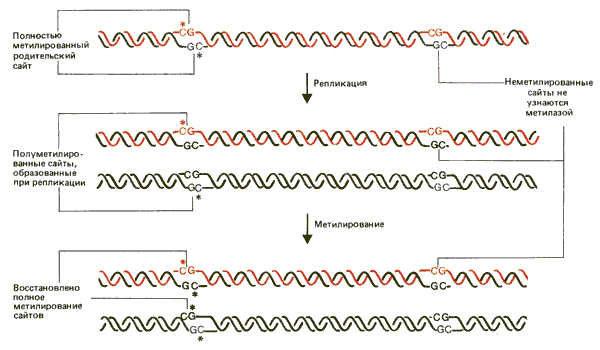
Рис. 30.15. Положение метилированных сайтов может воспроизводиться в потомстве с помощью фермента, который узнает в качестве субстрата только полуметилированные сайты.
Если это правильная модель, то совсем другая ферментативная активность должна участвовать в любом акте формирования новых сайтов метилирования (например, когда восстанавливается метилированное состояние гена, необходимое для прекращения транскрипции).
Существуют два пути, ведущие к тому, что сайт может утратить свое метилированное состояние: 1) метильная группа может быть активно удалена деметилирующим ферментом, или 2) может просто не происходить метилирования в полуметилированном сайте после репликации. Тогда в одном из дуплексов ДНК, образованных при репликации, не будет сайта метилирования.
В опытах с лекарственным препаратом 5-азацитидином получены данные, косвенно свидетельствующие о том, что деметилирование может вызвать экспрессию гена. Это соединение включается в ДНК вместо цитидина и не может быть метилировано, так как у него блокировано 5'-положение. В результате в ДНК появляются неметилированные сайты. Фенотипический эффект 5-азацитидина включает в себя индукцию изменений, нарушающих клеточную дифференцировку. Например, индуцируется развитие мышечных клеток из немышечных клеток-предшественников. Это соединение также активирует гены в молчащей Х-хромосоме, из чего можно сделать вывод о возможной роли метилирования в инактивации хромосомы.
Хотя пока мы еще не до конца разобрались в эффекте метилирования, уже очевидно, что отсутствие метальных групп ассоциируется с экспрессией гена. Однако предположение об общей регуляторной роли метилирования в генной экспрессии имеет свои слабые стороны. Так, например, в случае D. melanogaster (и других двукрылых насекомых) не обнаружено метилирования ДНК. Между тем другие различия между активным и неактивным хроматином у этих организмов такие же, как и у видов, которым свойственно метилирование. Таким образом, у Drosophila метилирование либо не нужно, либо оно заменено каким-то другим механизмом.
Первый эффект, наблюдаемый при расщеплении хроматина очень низкой концентрацией ДНКазы, - это индукция разрывов в двухцепочечной ДНК в специфических сайтах. В случае целого генома, например у D. melanogaster, в результате воздействия образуется серия специфических фрагментов, варьирующих в размере от 2 до 20 т.п.н. Эти фрагменты соответствуют участкам ДНК, расположенным между сверхчувствительными сайтами. Такие фрагменты не образуются при расщеплении свободной ДНК; они возникают (тканеспецифично) при расщеплении хроматиновой структуры.
Где локализованы эти сверхчувствительные сайты? Их положение можно установить для индивидуальных локусов, используя метод непрямого концевого мечения, о котором мы говорили ранее в связи с фазированием нуклеосом. Схема опыта воспроизведена на рис. 30.16. Хроматин расщепляют ДНКазой I, ДНК выделяют и затем расщепляют рестриктирующим ферментом. Смесь, полученную после двойного гидролиза, подвергают электрофорезу и гибридизуют с зондом, который соответствует участку, расположенному рядом с сайтом рестрикции. ДНКаза I делает разрез в определенном сайте, образуя дискретный фрагмент, размер которого указывает расстояние между сверхчувствительным сайтом и сайтом рестрикции.
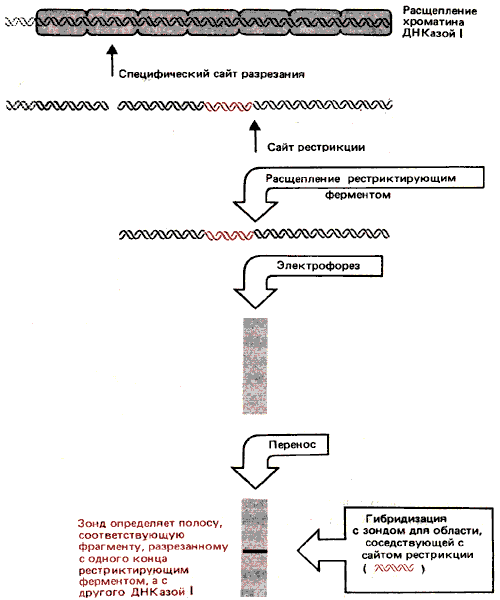
Рис. 30.16. С помощью метода непрямого концевого мечения определяют расстояние от сайта сверхчувствительности к ДНКазе до сайта рестрикционного расщепления.
Многие сверхчувствительные сайты связаны с экспрессией генов. Каждый активный ген имеет один или (иногда) более сайтов разрезания, расположенных в участке, непосредственно прилегающем к промотору со стороны, противоположной направлению транскрипции (с 5'-конца). Некоторые примеры локализации сверхчувствительных сайтов суммированы на рис. 30.17.
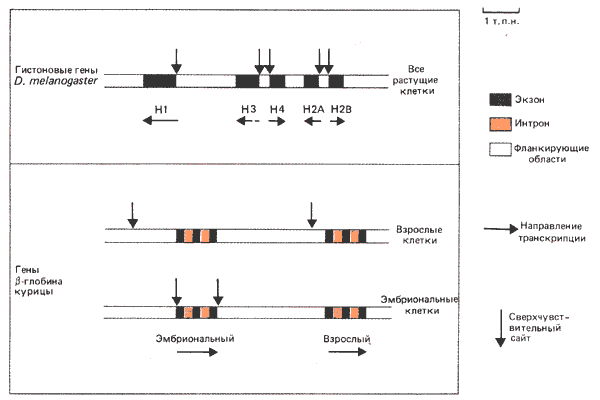
Рис. 30.17. Сверхчувствительные сайты располагаются около 5'-конца активных генов, а (иногда) также в других местах.
Помимо этих сайтов могут быть обнаружены сайты в других местах, в пределах транскрибируемого гена или на некотором расстоянии от него по ходу транскрипции (в сторону З'-конца). Значение сайтов, расположенных в других местах, неясно.
Корреляция между транскрипцией гена и сверхчувствительными сайтами, располагающимися в направлении 5'-конца, убедительно подтверждается данными, полученными при изучении гена Sgs4 D. melanogaster, кодирующего клейкий белок слюнных желез. В этой ткани в данном гене существуют два особенно сверхчувствительных сайта, лежащие на расстоянии 330 и 405 п.н. от 5'-конца гена. В мутантной линии мух есть делеция протяженностью 100 п.н., захватывающая оба сверхчувствительных сайта. Несмотря на то что еще остался отрезок более 250 п.н. «выше» стартовой точки транскрипции, у этого мутанта не образуется клейкого белка. Исходя из этих результатов, можно предположить, что удаление сверхчувствительного сайта нарушает активацию гена.
Присутствие сверхчувствительного сайта хотя и необходимо, но недостаточно для того, чтобы обеспечить транскрипцию. В естественных условиях трудно установить, через какое время после появления сверхчувствительных сайтов начинается транскрипция, поскольку нелегко получить клетки, находящиеся на одной и той же стадии развития. Однако это можно выполнить на определенных клетках эритроидного ряда курицы, иммортализованных в культуре с помощью РНК-содержащего опухолеродного вируса. Различные клеточные линии представляют разные стадии эритропоеза. В одной из таких линий уже имеются сверхчувствительные к ДНКазе сайты, но еще не начата транскрипция глобинового гена. Эта линия, возможно, захвачена на стадии между активацией сверхчувствительного сайта и началом генной экспрессии. Все указания, однако, свидетельствуют о том, что сверхчувствительный 5'-сайт (или сайты) появляется перед тем, как начинается транскрипция, и, очень возможно, служит предпосылкой инициации.
5'-Сайт разрезания обнаруживается только в хроматине клеток с экспрессирующими генами. В неактивных генах он не обнаруживается. Например, у глобиновых генов сверхчувствительные сайты расположены в 5'-направлении от генов эмбрионального глобина в эмбриональных клетках, но не во взрослых клетках, и наоборот. Такие сайты иногда могут различаться по чувствительности (судя по интенсивности соответствующих полос). При близком расположении множественных сайтов некоторые из них оказываются значительно чувствительнее других.
Каким образом возникают сверхчувствительные сайты? Для анализа их структуры нужна система in vitro. Сверхчувствительная область гена взрослого b-глобина цыпленка была воссоздана на плазмиде. Когда плазмида, несущая этот ген, соединялась с гистонами в присутствии экстракта из ядер эритроцитов, соответствующие участки становились сверхчувствительными. Очистка активного фактора должна быть достаточно простой: для определения можно использовать саму способность образования сверхчувствительных участков.
Экстракт не может придавать сверхчувствительность, если его добавлять после гистонов. Из этого следует, что соответствующий фактор в экстракте узнает ДНК непосредственно и каким-то образом меняет организацию данного участка, лишенного нуклеосом. По крайней мере, в этих условиях соответствующий компонент не может удалить нуклеосомы после того как они сформировались. Таким образом, мы возвращаемся обратно к исходному вопросу: каким образом изменяется структура хроматина, когда ген должен перейти в активное состояние?
Стабильность сверхчувствительного сайта была выявлена при изучении свойств куриных фибробластов, трансформированных температурочувствительными опухолеродными вирусами. В этих опытах используется необычное явление: хотя фибробласты не относятся к клеткам эритроидной линии, трансформация этих клеток при нормальной температуре приводит к активации глобиновых генов. В активированных генах имеются сверхчувствительные сайты. Если трансформацию проводят при более высокой (непермиссивной) температуре, не происходит ни активации глобиновых генов, ни появления сверхчувствительных сайтов. В тех случаях, когда глобиновые гены были активированы трансформацией при низкой температуре, их можно инактивировать повышением температуры. Но сверхчувствительные сайты сохраняются на протяжении по крайней мере 20 следующих клеточных делений.
Этот результат еще раз показывает, что образование сверхчувствительного сайта - это лишь одно из условий, необходимых для инициирования транскрипции. Из этого следует, что события, связанные с образованием сверхчувствительного сайта, отличаются от событий, связанных с его воспроизведением в потомстве. Однажды образованный сайт воспроизводится при репликации в отсутствие условий, необходимых для его индукции. (Вероятно, поэтому требуется специфическое вмешательство, для того чтобы удалить из молекулы сверхчувствительный сайт.)
Каким образом сверхчувствительные (или другие) сайты передаются следующему поколению при репликации ДНК? Можно представить разнообразные механизмы. Наследственное изменение может произойти в самой ДНК - например, деметилирование. В регулярной двойной спирали может происходить структурное изменение (при участии белков, восстанавливающих структуру после каждой репликации). Высококооперативные белки могут образовывать комплекс (с двухцепочечной ДНК), который способен распадаться на отдельные компоненты при репликации, а потом восстанавливаться (см. рис. 29.20).
Мы рассмотрели три изменения, обнаруженные в активных генах: 1) появление сверхчувствительного сайта (сайтов) около промотора; 2) более высокая чувствительность нуклеосомного домена, включающего транскрибируемую область к ДНКазе I; 3) недометилирование ДНК в транскрибируемой области. Все эти изменения могут быть необходимы для транскрипции.
Какова природа сверхчувствительных сайтов? Каждый из них представляет собой область размером 100-200 п.н., доступ к которой не ограничивается типичным для нуклеосом способом. Некоторые из этих сайтов изучены детально.
Сайт на 5'-конце 3-глобинового гена взрослого типа у курицы предпочтительно расщепляется несколькими ферментами, включая ДНКазу I, ДНКазу II и нуклеазу микрококков. На карте, изображенной на рис. 30.18, показано, что сайты, предпочитаемые этими ферментами, лежат довольно близко друг от друга в пределах одной области.
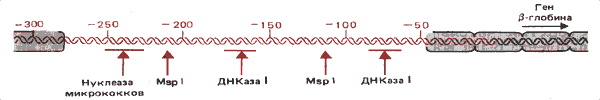
Рис. 30.18. Сверхчувствительный сайт bглобинового гена курицы занимает область, чувствительную к нескольким нуклеазам.
Рестриктирующий фермент MspI расщепляет два сайта этой области. Часть фрагментов, образованных этим ферментом, оказывается в виде свободной ДНК. Таким образом, в период транскрипции область, расположенная от — 60 до — 260, становится предпочтительно чувствительной к нуклеазам.
В сходных экспериментах показано, что 5'-сверхчувствительный сайт гена тимидин-киназы вируса герпеса занимает область от — 4 до — 182. Сайты-мишени этой области предпочтительно расщепляются рестриктирующими ферментами.
ДНК сверхчувствительных сайтов активных генов глобина у кур расщепляются нуклеазой S1, субстратом которой служит одноцепочечная ДНК. Исходя из этого, было высказано предположение, что само состояние двухцепочечной ДНК в сверхчувствительном сайте может быть модифицировано.
В сверхчувствительной области гена b-глобина цыпленка нуклеаза S1 расщепляет сайты, лежащие в участках с необычной последовательностью. Это отрезки ДНК, одна из цепей которых целиком состоит из пуринов, а другая из пиримидинов. Некоторые особенности сайтов расщепления свидетельствуют о том, что они представляют собой не одноцепочечные ДНК: их узнают рестриктирующие ферменты, действующие только на двухцепочечную ДНК, и не узнает фермент, специфичный к одноцепочечной ДНК. Из этого можно, очевидно, сделать вывод, что такие сайты имеют несколько необычную структуру, что позволяет нуклеазе S1 узнавать их, хотя при этом не образуется настоящих одноцепочечных участков.
Сверхчувствительный сайт представляет собой изменение структуры хроматина. Есть основания думать, что такой сайт состоит из последовательности, не участвующей в образовании обычной нуклеосомной структуры, возможно, потому, что с этой ДНК связываются другие белки. Если нуклеосомы все-таки образуются в сверхчувствительной области, их структура должна отличаться от обычной.
Важная особенность сверхчувствительных сайтов заключается в том, что они могут проявлять свою активность на различных расстояниях от точки начала транскрипции. В гене Sgs D. melanogaster сайт удален более чем на 250 п.н. в 5'-направлении; в гене b-глобина курицы он расположен непосредственно рядом с 5'-стороны, а в гене тимидин-киназы эта область включает в себя все последовательности, необходимые для функции промотора. Сверхчувствительные сайты могут участвовать в промоторной функции непосредственно, вероятнее всего создавая необходимые условия для узнавания РНК-полимеразного участка, расположенного перед промотором (гл. 11). Но можно предположить также, что эти сайты играют более общую роль в активации гена - например индуцируя локальное структурное изменение, необходимое для связывания РНК-полимеразы или даже для ее синтетической активности.
Особенно хорошо изучена чувствительная к нуклеазе область мини-хромосомы вируса SV40. Короткий сегмент около точки начала репликации, непосредственно предшествующий промотору для поздней единицы репликации, предпочтительно расщепляется ДНКазой I, нуклеазой микрококков и другими нуклеазами (в том числе рестриктирующими ферментами). По минимальной оценке область предпочтительного расщепления имеет в длину 400 п.н., причем этот фрагмент может быть вырезан в виде свободной ДНК.
Состояние мини-хромосомы вируса SV40 можно увидеть под электронным микроскопом. В участке, составляющем до 20% всего образца, заметен пробел в нуклеосомной организации. Это хорошо видно на электронной микрофотографии (рис. 30.19). Пробел длиной около 120 нм (примерно 350 п. н.) с обеих сторон окружен нуклеосомами, занимающими весь остальной геном. Положение пробела можно определить, расщепив кольцевую мини-хромосому с помощью рестриктирующего фермента, для которого известен лишь один сайт-мишень. Видимый пробел соответствует области, чувствительной к нуклеазам. Это прямо показывает, что повышенная чувствительность к нуклеазам коррелирует с отсутствием нуклеосом.
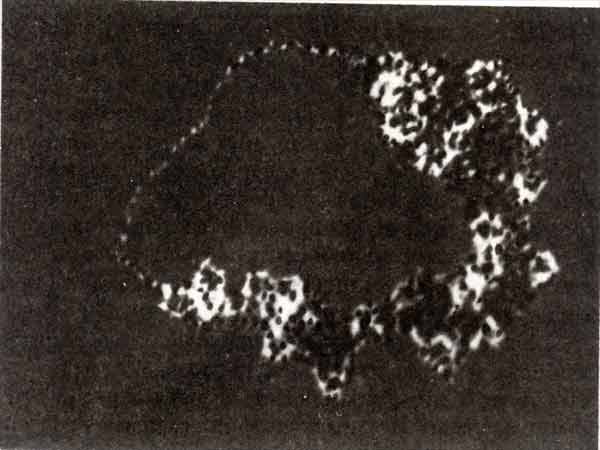
Рис. 30.19. В мини-хромосоме вируса SV40 может быть безнуклеосомный пробел. (Фотография любезно предоставлена Moshe Yaniv.)
Отсюда, однако, не следует, что данная ДНК свободна от нуклеосом in vivo, поскольку вполне возможно, что при выделении мини-хромосомы была потеряна какая-то другая белковая структура.
Подобный нуклеазочувствительный пробел в нуклеосомной организации найден у родственного вируса полиомы. В этом случае было показано, что различные участки этой области не в одинаковой степени чувствительны к нуклеазам. Внутри чувствительной области размером 260 п.н. находятся два сверхчувствительных сайта и «защищенный» участок. Карта этой области показана на рис. 30.20.
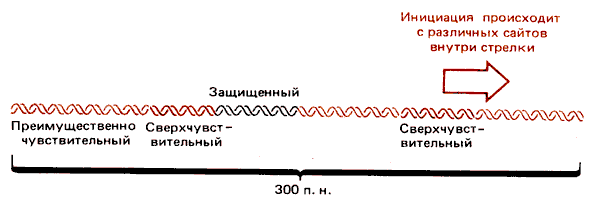
Рис. 30.20. В безнуклеосомном пробеле вируса SV40 имеются сверхчувствительные сайты, чувствительные участки и «защищенная» область ДНК.
Защищенный участок, вероятно, представляет собой ДНК, связанную с белком. И действительно, вполне возможно, что наличие таких комплексов обусловливает отсутствие нуклеосом в данной области.
Точно такой же результат наблюдают у мутанта вируса полиомы с существенными перестройками в этой области. Из сказанного следует, что наличие без нуклеосомного пробела определяется не всей последовательностью ДНК в самой чувствительной области, а должно быть «отмерено» некоторым образом от фиксированной точки, являющейся либо частью этой области, либо находящейся рядом с ней.
Область вируса SV40 или полиомы, окаймляющая чувствительный к нуклеазе пробел, имеет несколько потенциальных функций, и, следовательно, ее нельзя просто считать структурой, активирующей промотор. Наличие пробела может быть связано с последовательностями элементов усилителя транскрипции (энхансер, enhancer), которые находятся в этой области и которые необходимы для функции промотора (гл. 11).
Интересная структура была обнаружена во вне хромосомной рДНК макронуклеуса Tetrahymena pyriformis. Напомним, что молекулы рДНК представляют собой линейные палиндромы, в которых две транскрипционные единицы рДНК расположены на некотором расстоянии друг от друга и транскрибируются в противоположных направлениях. Изучение организации рДНК показало, что близко от центра палиндрома расположены два участка начала репликации. Это короткие последовательности, с которых начинается репликация ДНК. Структура хроматина в этой области показана в утолщенной части карты.
В этой области находятся несколько сверхчувствительных сайтов, по одному сайту на каждый промотор и каждый участок начала репликации. Между двумя участками начала репликации располагается серия из 5 нуклеосом. Участки начала репликации разделены промежутками в 1000 п.н., и участок, приходящийся на каждую нуклеосому, равен точно 200 п.н., так что каждая нуклеосома находится в точно определенном положении. У организма, родственного Т. pyriformis, центральная область между участками начала репликации составляет 1400 п.н.и заполнена семью нуклеосомами.
рДНК Tetrahymena служит совершенным примером нуклеосомного фазирования. Тот факт, что две копии рДНК различаются целым числом нуклеосомных повторов, дает основание думать, что, по-видимому, давление отбора способствовало отбору вариантов, у которых центральная область упакована в строго определенное число нуклеосом. Локализация гистоновых октамеров, вероятно, определяется границами соседних сверхчувствительных сайтов, а не свойствами самой фазируемой последовательности.
Подобные структурные изменения хроматина могут происходить у дрожжей в области центромеры. В данном случае кажется вероятным, что вместо видимого кинетохора сама нить хроматина выполняет функцию центромеры. Строение центромерной области было исследовано методом непрямого концевого мечения с использованием коротких фрагментов ДНК в качестве зондов. С помощью зондов были идентифицированы два сверхчувствительных к ДНКазе I сайта, локализованные с обеих сторон от областей I и III. Это короткие консервативные последовательности центромерной ДНК, приведенные на рис. 28.11. Область размером 220-250 п. н. между двумя сверхчувствительными сайтами защищена от нуклеазного расщепления.
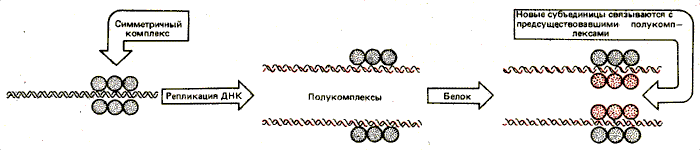
Рис. 30.21. Белковый комплекс может воспроизводиться на ДНК, расщепляясь на полукомплексы при репликации и кооперативно добирая затем недостающие белковые молекулы для восстановления полных комплексов.
Роль консервативной области, возможно, заключается в связывании специфических белков и образовании безнуклеосомной структуры.
При расщеплении хроматина нуклеазой микрококков в том же самом эксперименте наблюдается другой эффект. В этом случае также обнаружено наличие защищенной области, но, кроме того, с обеих сторон от нее располагаются фазированные серии нуклеосом. Фазирование захватывает более 12 нуклеосом, каждая из которых содержит ДНК длиной 160 п.н. Этот результат находится в противоречии с очевидной утратой фазирования нуклеосом в других участках дрожжевого генома.
Распространяется ли фазирование нуклеосом от центромерной последовательности, или же это свойство самих фазированных последовательностей? В плазмиде, содержащей эти последовательности, но не имеющей центромерной области, фазирование сохраняется. Из этого следует, что естественная центромерная область характеризуется двумя особенностями. Консервативная последовательность образует некую безнуклеосомную структуру. А фланкирующим последовательностям присуща способность фазировать свои нуклеосомы.
Что происходит с нуклеосомами, расположенными на конце хромосомы? При расщеплении теломер инфузории Oxytricha нуклеазой микрококков получается серия повторяющихся полос на расстояниях 100, 300, 500, 700, 900 п. н. от конца.
На основе такого разделения делают вывод, что самые последние 100 п.н. теломеры защищены ненуклеосомным белковым комплексом, рядом с которым располагается серия фазированных нуклеосом.
Наличие сверхчувствительных сайтов может отражать более общее явление. Возможно, что особые (пока еще неизвестные) белки модифицируют короткие участки ДНК так, что нуклеосомы не образуются. Структуры, Сформированные в каждом отдельном случае, не обязательно должны быть похожи между собой (за исключением того, что каждая, по определению, образует сайт сверхчувствительности к ДНКазе I). Мы видели, что сайты, характеризующиеся сверхчувствительностью, предшествуют транскрибируемым генам в нуклеазочувст-вительном пробеле вирусов SV40 и полиомы и в дрожжевой центромере. Такие сайты могут быть связаны с транспозицией генов типа спаривания у дрожжей (гл. 37).
Эти различные структуры могут служить многим целям, и будет неудивительно, если их обнаружат в других подобных ситуациях.
Можно лишь рассуждать о том, будет ли справедливым суждение, обратное этому принципу: гены, регуляторные участки которых организованы в нуклеосомы, не могут экспрессироваться. Предположим, что образование нуклеосом происходит независимо от последовательности в любом участке ДНК, из которого специально не удалены гистоны. Тогда в отсутствие специфических регуляторных белков промоторы, усилители транскрипции и другие регуляторные участки будут организованы с помощью гистоновых октамеров в такое состояние, в котором они, возможно, не могут быть активированы. (Доказательств существования какого-либо белка, способного удалять гистоны с ДНК, нет.)
Имеются некоторые основания думать, что для активации гена необходимо нарушение структуры хроматина. Фактор транскрипции гена 5S-PHK не активирует in vitro гены, если они находятся в комплексе с гистонами. Однако этот фактор может образовывать необходимый комплекс со свободной ДНК, после чего добавление гистонов не снимает остаточной активности генов. Уже связанный с ДНК фактор остается на своем месте, позволяя молекулам РНК-полимеразы последовательно инициировать транскрипцию. Критичным в этой ситуации может оказаться то, кто первым (фактор транскрипции или гистоны) свяжется с регуляторным сайтом.
При репликации происходит очевидное нарушение структуры хроматина, так как нуклеосомы должны временно отсутствовать по крайней мере в одной из дуплицированных хромосом. При этом другие белки могут связываться с регуляторным сайтом и препятствовать образованию нуклеосом. Безнуклеосомный участок может быть узнан по сверхчувствительному сайту и может служить границей, с которой начинается фазирование нуклеосом.
Каким образом можно проверить предположение, что изменение состояния хроматина часто связано с репликацией? Системой нужного нам типа могла бы быть (к примеру) индукция в генах сверхчувствительных сайтов в ответ на действие гормонов. Однако четкий ответ на вопрос о том, как образуются активные районы, будет зависеть от разработки таких систем, которые можно будет использовать для активации структуры хроматина in vitro (что может оказаться трудным, если репликация ДНК действительно необходима).
Сверхчувствительный сайт (или какая-то другая активирующая структура) сформированный однажды, может сохраняться при репликации. Это может происходить в том случае, если фактор способен сегрегировать при репликации.
На рис. 30.21 показан гипотетический случай: белок, кооперативно связывающийся с ДНК, образует комплекс, который расщепляется при репликации. Каждый полукомплекс затем достраивается в полный на дочерних хромосомах.
Поскольку реконструкция комплекса обязательна при каждой репликации, можно предположить, что ген, возможно, выключается в делящейся клетке просто из-за ограниченного количества фактора. Если при делении фактор разводится, комплекс не сможет образовываться снова и гистоны образуют нуклеосомы в регуляторных участках. Этим можно объяснить, как происходит выключение генов в процессе эмбрионального развития. Отсюда возникает вопрос, каким образом могут выключаться гены в неделящихся клетках. Действительно, могут ли выключаться гены в терминально дифференцированных клетках (т. е. в клетках, достигших конечной стадии фенотипического выражения)?
Точный механизм активации (или инактивации) хроматина пока еще слишком гипотетичен, однако общая нить рассуждений сводится к тому, что активное и неактивное состояния хроматина не могут находиться в динамическом равновесии: чтобы перевести одно состояние в другое нужны неожиданные, внезапные события. Исходя из рассмотренных нами типов моделей можно сделать вывод, что для инициирования активации, возможно, нужна гораздо большая концентрация регуляторного белка, чем для сохранения активного состояния хроматина.
События, участвующие в активации гена, не должны совпадать с инициированием транскрипции. Образование соответствующего комплекса может обусловить способность гена к транскрипции, но чтобы транскрипция действительно произошла, может понадобиться дополнительное условие. На языке биологии развития образование комплекса может означать процесс детерминации, происходящий несколько раньше процесса дифференцировки, который действительно включает ген. Возможным примером могут служить, гены, экспрессия которых зависит от гормонов.
В соответствующей клетке они сначала могут прийти в состояние детерминированности, а затем при появлении гормона может начаться их транскрипция. (B таком случае гены прокариот контролируются по механизму типа дифференцировки, так как их активация совпадает с началом транскрипции, а не приводит сначала к образованию компетентного состояния).
Темы, затронутые в этой главе, рассматриваются Льюином (Lewin, Gene Expression, 2, Eucariotic Chromosomes Wiley, New York, 394-427, 1980). Данные по функциональным аспектам хроматина представлены Иго-Кеменесем, Хорцем и Цахау (Igo-Kamenes, Horz and Zachau, Ann. Rev. Biochem., 51, 89-121, 1982). Существование сверхчувствительных сайтов кратко обсуждается в работе Элгин (Elgin, Cell, 27, 413-415, 1981). Их наследованию дочерними клетками посвящена статья Граудина и Вайнтрауба (Groudine, Weintraub, Cell, 30, 131-139, 1982). Серию наиболее результативных экспериментов, посвященных исследованию изменений в транскрибируемых генах, описали Вайнтрауб, Ларсен и Граудинг (Weintraub, Larsen, Groudine, Cell, 24, 333-344, 1981), а также Вайсброд, Граудин и Вайнтрауб (Weisbrod, Groudin, Weintraub, Cell, 19, 289-301, 1980). Моделям метилирования посвящен обзор Разина и Риггса (Rasin, Riggs, Science, 210, 609-610, 1980). Результаты исследования вирусных безнуклеосомных пробелов собраны и подытожены в сообщении Хербомела и др. (Herbomel et al., Cell, 25, 651-658, 1981). Структуру центромеры выяснили Блум и Карбон (Bloom, Carbon, Cell, 29, 305-317, 1982). Великолепный обзор, посвященный вопросам формированного и поддержанию структуры активного гена приведен Брауном (Brown, Cell. 37. 359-365. 1984.)