
Б.ЛЬЮИН
Гены
Перевод с английского канд.биол.наук А.Л.Гинцбурга, д-ра биол.наук Т.С.Ильиной, канд. биол. наук Э.С.Каляевой и канд.биол.наук Т. Ю. Переслени
под редакцией чл.-корр. АН СССР Г.П.Георгиева
Москва «Мир» - 1987
Часть Х
ДИНАМИЧНОСТЬ ГЕНОМА: ПОСТОЯННОЕ ИЗМЕНЕНИЕ ДНК
Глава 29
Нуклеосомные частицы и структура хроматина
Одним из наиболее замечательных достижений за последние десять лет явилось установление общей структуры хроматина. До этого мы знали только, что хроматин содержит ДНК, РНК и белок, организованные в компактную форму, в которой большинство последовательностей ДНК оказываются структурно недоступными и функционально неактивными. Считали, что причина этой недоступности заключается в связи с белком (часто писали, что ДНК «покрыта» белками), однако не было никакой информации о структуре этого нуклеопротеина на уровне взаимодействия ДНК—белок.
Огромный прогресс был достигнут с тех пор, как в 1974 г. удалось установить тот существенный факт, что хроматин сконструирован из субъединиц, имеющих одинаковый тип организации у всех эукариот. Эта субъединица состоит примерно из последовательности ДНК в 200 п.н., которая структурно организована с помощью небольших основных белков (гистонов) в частицу, похожую на бусинку. Оказалось, что ДНК лежит на поверхности этой частицы, тогда как белковые компоненты находятся внутри.
С точки зрения фундаментальных представлений о ДНК-белковых взаимодействиях мы можем описать структуру отдельной частицы, проследив прохождение нити ДНК и ее взаимодействие с белками, а также взаимодействие отдельных белков между собой. Можно задать вопрос: существуют ли вариации в конформации частиц; как такие вариации сказываются на функциях хроматина? Что происходит с частицами при транскрипции и репликации хроматина? Для этих процессов могут быть необходимы другие (негистоновые) белки, чтобы модулировать поведение частиц.
При репликации происходит воспроизведение определенной серии частиц. Кроме удвоения количества ДНК хроматина должно также удвоиться количество белка. Наряду с вопросом о том, как устроены частицы, необходимо выяснить, что происходит с другими белками, присутствующими в хроматине. Поскольку репликация, вероятно, нарушает структуру хроматина, при этом, с одной стороны, возникает проблема сохранения участков со специфической структурой, с другой же, создается возможность внести в нее изменения.
Общая высокая плотность упаковки генетического материала говорит о том, что ДНК не может непосредственно укладываться в хроматин с окончательной структурой. Должны существовать иерархические ступени организации.
Первый уровень - это закручивание ДНК в бусовидные частицы с плотностью упаковки около 6. Эти частицы являются неизменной составной частью эухроматина, гетерохроматина и хромосом. Второй уровень организации заключается в закручивании серий бус в спиральную структуру с образованием волокон размером около 30 нм, которые найдены в интерфазном хроматине и в митотических хромосомах (см. рис. 28.7). При этом плотность упаковки хроматина достигает 40. Пока точно не известно, увеличивается ли плотность упаковки фибрилл в митотической хромосоме или она остается прежней.
Окончательная плотность упаковки зависит от третьего уровня организации, т.е. от укладки самой фибриллы. При этом плотность упаковки в эухроматине возрастает до >=1000. Это значение периодически изменяется при образовании митотических хромосом и достигает <=10000. Данный процесс, вероятно, также регулируется негистоновыми белками (и, возможно, также включает химическую модификацию гистонов), как и в случае образования различий между эухроматином и гетерохро-матином.
Относительная доля компонентов хроматина варьирует в зависимости от источника и метода выделения. Масса белка почти в 2 раза превышает массу ДНК. Белки подразделяются на два типа: гистоны и негистоновые белки. Масса РНК составляет менее 10% массы ДНК. Большая часть РНК состоит из новосинтезированных цепей, которые еще связаны с ДНК-матрицей.
Гистоны составляют большинство основных белков хроматина и находятся примерно в том же количестве, что и ДНК. По относительной доле основных аминокислот каждого типа, которую выражают отношением лизин/аргинин, сначала охарактеризовали пять типов гистонов. След этой классификации до сих пор остается в названиях гистонов. Практически у всех эукариот обнаруживают одни и те же классы гистонов. Их свойства суммированы в табл. 29.1.
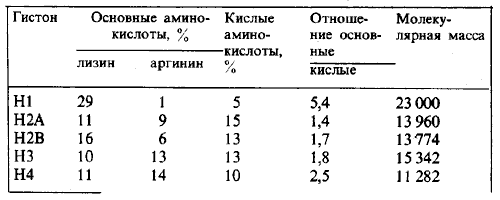
Таблица 29.1. Гистоны - это сильноосновные белки.
Эти данные относятся к гистонам млекопитающих (крупный рогатый скот); остальные гистоны имеют аналогичный состав.
Гистоны четырех классов прямо взаимодействуют с ДНК и образуют в хроматине серию частиц первого уровня организации. Консервативность типов гистонов на протяжении эволюции можно объяснить необходимостью сохранения этой важнейшей реакции. Пятый класс гистонов принимает участие во взаимодействиях между частицами. Постоянство классов гистонов позволяет предполагать, что взаимодействия типа ДНК—гистоны, гистон—гистоны и гистон—негистоновые белки могут быть в основном похожими у разных видов. Отсюда мы можем сделать заключение об общих механизмах образования как первичных частиц, так и последующих структур более сложного порядка, состоящих из серий частиц.
Гистоны первых четырех классов имеют значительное количество как кислых, так и основных аминокислот. Поэтому эти белки несут высокий заряд. Отношение основных аминокислот к кислым находится в диапазоне 1,4-2,5. Эти гистоны подразделяются на две группы.
К аргинин-богатым относятся два вида гистонов: Н3 и Н4. Они принадлежат к наиболее консервативным из всех известных белков. Аминокислотные последовательности этих белков идентичны даже у таких удаленных видов, как корова и горох. В гистонах Н3 и Н4 других видов обнаружены только редкие аминокислотные замены. Консервативность целой последовательности говорит о том, что все ее аминокислоты имеют существенное значение для выполнения функции белка. По логике вещей эта функция должна быть одинаковой у огромного большинства различных видов, что свидетельствует в пользу концепции об общей основе для структуры хроматина.
К гистонам, умеренно обогащенным лизином, относятся два белка. Их называют Н2А и Н2В (в противоположность их номенклатурному обозначению это не родственные, а независимые белки). У различных эукариот находят те же самые два типа гистонов, но у них обнаружены заметные межвидовые вариации в аминокислотной последовательности.
Пятый класс представлен гистонами, очень богатыми лизином; он состоит из нескольких достаточно близкородственных белков с перекрывающимися последовательностями аминокислот. Это гистоны H1 (в эритроцитах птиц существует вариант, названный Н5). У этих гистонов обнаружены значительные межвидовые и межтканевые вариации (у дрожжей, по-видимому, гистонов данного класса нет). Хотя эти гистоны являются самыми основными гистонами, их легко можно выделить из хроматина, полностью растворив в солевом растворе (0,5М).
Как и следует из названия, негистоны - это все другие белки хроматина. Предполагается поэтому, что они обладают большими видовыми и тканевыми различиями, хотя строгих данных о степени их разнообразия пока нет. Эти белки составляют меньшую долю от всей массы белков хроматина, чем гистоны. Кроме того, сюда относится намного большее число белков, так что любой индивидуальный белок присутствует в значительно меньшем количестве, чем любой гистон.
В класс негистоновых белков могут попасть белки, связанные с экспрессией генов, и белки, участвующие в организации структур высшего порядка. Так, в числе наиболее выдающихся негистонов можно назвать РНК-полимеразу. HMG-белки (высокомобильная группа) составляют отдельный, хорошо различимый подкласс негистонов. Основная проблема, возникающая при работе с другими негистоновыми белками - их загрязнение другими ядерными белками.
Если интерфазные ядра суспендировать в растворе с низкой ионной силой, они разбухнут и в местах разрывов из них высвободятся нити хроматина. На рис. 29.1 показано лизировавшее ядро, из которого вытекают нити. В некоторых местах нити хроматина состоят из плотноупакованного материала, но в тех местах, где они вытянуты, можно видеть, что они состоят из отдельных частиц. Эти частицы называют нуклеосомами. В особенно вытянутых участках видно, что индивидуальные нуклеосомы соединены тонкой нитью - это свободная двухцепочечная ДНК. Таким образом, непрерывная двухцепочечная ДНК проходит через серию частиц.
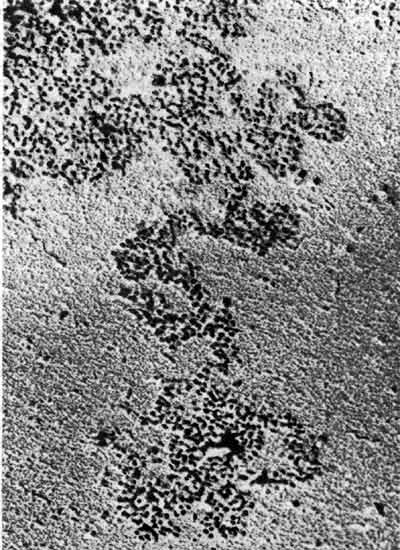
Рис. 29.1. Хроматин, вытекающий из лизированного ядра, состоит из серии плотноорганизованных частиц. (Фотография любезно предоставлена Pierre Chambon.)
Индивидуальные нуклеосомы можно получить, обработав хроматин ферментом нуклеазой микрококков. Это эндонуклеаза, которая разрезает нить ДНК в местах соединения между нуклеосомами. Сначала освобождаются группы частиц, а потом отдельные нуклеосомы. Мономерные нуклеосомы отчетливо видны на рис. 29.2 в виде компактных частиц (настоящая форма которых похожа на диск; см. ниже). Они седиментируют примерно со скоростью 11S, что соответствует общей массе в диапазоне 250000-300000 дальтон. Отношение белок/ДНК составляет около 1,25. Димеры, тримеры и т.д. имеют соответствующие свойства при биохимическом анализе или при наблюдении под электронным микроскопом.

Рис. 29.2. Индивидуальные нуклеосомы высвобождаются в результате расщепления хроматина нуклеазой микрококков. Размер отрезка 100 нм. (Фотография любезно предоставлена Pierre Chambon.)
Мономерные нуклеосомы содержат ДНК ( ~ 200 п. н.), связанную с гистоновым октамером. Этот октамер содержит гистоны Н2А, Н2В, НЗ и Н4 - по две копии каждого. Иногда их называют гистоновой сердцевиной (гистоновым кором). Такие комплексы схематически изображены на рис. 29.3.
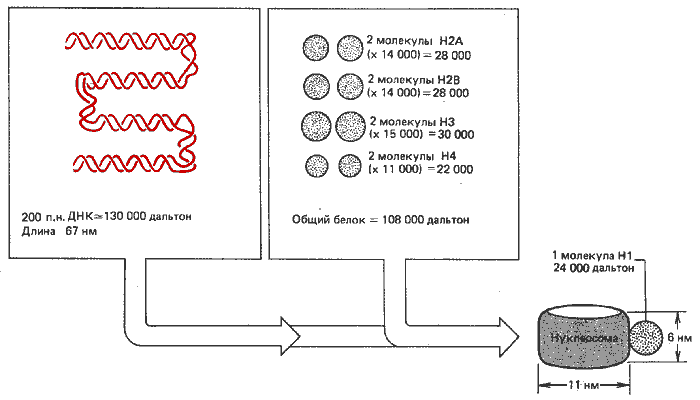
Рис. 29.3. Нуклеосомы состоят из ДНК и гистонов примерно равной массы (включая гистон H1).
Эта модель объясняет стехиометрию гистоновой сердцевины в хроматине, в котором Н2А, Н2В, НЗ и Н4 находятся в эквимолярных количествах, по одной молекуле каждого на ~ 100 п. н. ДНК. Прямое экспериментальное доказательство ассоциации в гистоновые октамеры получено методом образования перекрестных сшивок. В результате четыре из гистонов сердцевины сшиваются перекрестно и образуют серию полос, по размеру достигающих октамер.
Одна молекула гистона H1 связывается с каждой нуклеосомой. Его общее стехиометрическое количество в хроматине в два раза меньше, чем количество других гистонов. При выделении мультимерных нуклеосом он обычно присутствует в эквимолярном количестве, но в препаратах мономеров его содержание меньше. Весь H1 можно удалить, не нарушая структуры нуклеосом; из этого следует, что белок локализован снаружи. Общая масса ДНК и белка, включая H1, в расчете на нуклеосому составляет около 262000 дальтон. При этом количество ДНК примерно равно количеству белка. Это приближенная оценка, полученная из экспериментальных значений. Любое дополнительное увеличение содержания белка зависит от присутствия небольшого количества негистоновых белков, которые связываются с нуклеосомами.
Гистон H1 может лежать в месте соединения двух соседних нуклеосом. Это предположение согласуется со старыми данными о том, что H1 достаточно легко удаляется из хроматина, причем такой оставшийся хроматин легче «растворяется». Более современные данные также подтверждают, что после удаления H1 легче получить структуры, похожие на вытянутые нитки бус (см. ниже).
Простой диагностический тест на присутствие нуклеосом был разработан на основе данных о том, что ДНК в хроматине организована в регулярно повторяющуюся структуру. Если выделенные ядра или хроматин обработать нуклеазой микрококков (или в некоторых случаях просто выделить и обработать экзогенным ферментом), ДНК расщепляется на интегральное множество единиц длины. При этом в результате фракционирования методом электрофореза в геле образуется «лестница», показанная на рис. 29.4. Такие лестницы состоят из 10 или более ступенек, и единица длины, измеренная по возрастанию последовательных ступенек, равна примерно 200 п. н. Как показано на рис. 29.5, это наблюдение коррелирует со свойствами отдельных нуклеосом. Анализ выделенных частиц представлен в верхней части рисунка. Препарат нуклеосом был расфракционирован на мономеры, димеры, тримеры и т.д. методом седиментации в градиенте концентрации сахарозы. Затем очищали ДНК из каждой фракции и анализировали с помощью электрофореза в акриламидном геле.
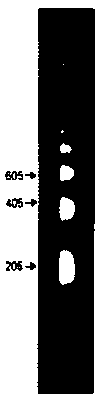
Рис. 29.4. Нуклеаза микрококков расщепляет ядерный хроматин на мультимерные серии отрезков ДНК, которые можно разделить с помощью электрофореза. (Фотография любезно предоставлена Markus Noll.)
Электрофорез образцов ДНК показан в нижней части рисунка. Каждая фракция образует полосу ДНК определенного размера. Отдельные полосы соответствуют определенным ступеням лестницы, полученной в результате расщепления хроматина. (Справа на фотографии представлена для сравнения «лестница».) Нуклеосомы- мономеры содержат одну единицу длины ДНК, димеры нуклеосом содержат две единицы длины ДНК и т.д.
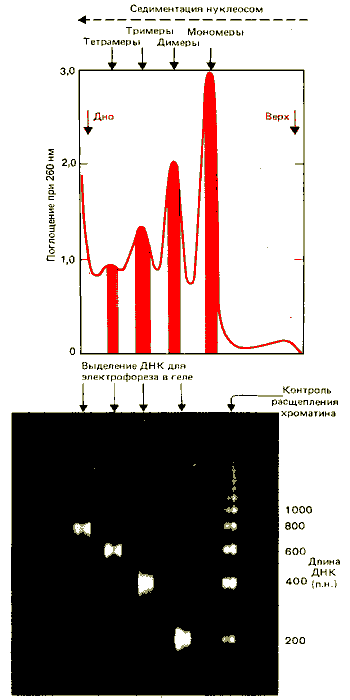
Рис. 29.5. Каждый мультимер нуклеосом содержит соответствующее число единиц длины ДНК. (Фотография любезно предоставлена John Finch.)
Каждая ступенька лестницы представляет собой ДНК, соответствующую определенному числу нуклеосом. Таким образом, можно принять, что существование «лестницы», кратной 200 п. н., указывает на нуклеосомную организацию ДНК. При обработке нуклеазой микрококков образуется «лестница» только примерно из 2% ядерной ДНК, которая переходит в кислоторастворимую фракцию (деградирует до мелких фрагментов). Таким образом, реагирует только часть ДНК, по-видимому соответствующая особенно чувствительным областям.
При высвобождении хроматина из ядра или при конструировании нуклеосом in vitro (см. ниже) мы часто видим серии нуклеосом, соединенных нитью свободной ДНК (бусинки на нитке). Разделены ли обычно нуклеосомы свободной ДНК, или это артефакт, возникающий in vitro? Поскольку in vivo ДНК должна быть плотно упакована, можно a priori предположить, что существует (если вообще есть) только небольшое количество свободной ДНК. Это предположение подтверждается данными о том, что более 90% ДНК хроматина оказывается в форме «лестницы» из фрагментов, кратных 200 п. н. Из этого следует, что большая часть ДНК находится в нуклеосомах, а не между ними. В естественном состоянии нуклеосомы, вероятно, так плотно упакованы, что ДНК непосредственно переходит из одной нуклеосомы в другую. Свободная же ДНК, по-видимому, образуется в результате утраты некоторых гистоновых октамеров в процессе выделения.
Длина ДНК, находящейся в одной нуклеосоме, может несколько отличаться от величины 200 п. н., которая была установлена в первых экспериментах. После того как были исследованы полные геномы из отдельных клеток, оказалось, что в каждом случае полученное значение достаточно точно соответствовало средней величине ( +- 5 п.н.). Средняя величина в большинстве случаев находилась между 180 и 200 п.н., но были обнаружены и крайние значения, такие, как 260 п. н. (в сперматозоидах морского ежа). Среднее значение может меняться в течение эмбрионального развития. В случае морского ежа оно уменьшается до более типичного уровня во время ранних делений эмбриональных клеток. Среднее значение может быть различным в разных тканях взрослого организма. Кроме того, различия могут наблюдаться в разных частях генома в клетках одного типа. Например, известны случаи отличия от среднегеномной величины для сателлитной ДНК и генов 5S РНК.
Белковый компонент нуклеосомы представлен гистоновым октамером, вероятно, у всех эукариот. Такое постоянство структуры и функции объясняет строгую консервативность аминокислотных последовательностей гистонов. Чрезвычайная консервативность гистонов НЗ и Н4 объясняется тем, что их роль может быть центральной и неменяющейся, тогда как гистоны Н2А и Н2В обеспечивают видоспецифические вариации.
Все нуклеосомы состоят из гистонового октамера, связанного с ДНК определенной длины. Какие же факторы отвечают за вариацию длины ДНК в нуклеосомах, полученных из различных источников? На этот вопрос легче ответить, определив то, что не вызывает вариаций. Вариации не зависят от изменения в связывании ДНК с гистоновым октамером. Всегда образуются частицы минимальной нуклеосомы (нуклеосомного кора, кор-частицы, core particle), содержащие 146 п. н. ДНК, независимо от общей длины ДНК в нуклеосоме. Таким образом, варьирует размер ДНК, которая присутствует в нуклеосоме сверх основной структуры кора.
Минимальная нуклеосома была идентифицирована по действию нуклеазы микрококков на нуклеосомный мономер. Реакция этого фермента начинается с введения разреза между нуклеосомами. Но если продолжить реакцию после того, как образованы мономеры, то расщепление захватывает часть ДНК самой нуклеосомы. Эта реакция протекает путем «подрезания» ДНК с концов нуклеосомы.
Как показано на рис. 29.6, длина ДНК уменьшается ступенчато. Например, в ядрах печени крысы нуклеосомные мономеры сначала содержали отрезок ДНК в 205 п.н. Потом были обнаружены мономеры, у которых длина ДНК была уменьшена до 160-170 п.н. Затем длина этих мономеров сократилась до размера ДНК в минимальной нуклеосоме - 146 п. н. (эта величина достаточно стабильна, однако, если продолжать гидролиз, разрезы образуются и в пределах такой ДНК. При этом образуется набор фрагментов, из которых самые длинные соответствуют фрагменту ДНК минимальной нуклеосомы, а самые короткие имеют размер 20 п. н.).

Рис. 29.6. Нуклеаза микрококков ступенчато уменьшает длину ДНК нуклеосомных мономеров. (Фотография любезно предоставлена Roger Kornberg.)
На основе такого анализа можно разделить нуклеосомную ДНК на две части. ДНК минимальной нуклеосомы имеет постоянную длину 146 п.н. и относительно устойчива к расщеплению нуклеазами. (Другие нуклеазы, в том числе и нуклеаза микрококков, останавливаются перед этим отрезком ДНК.) Линкерная ДНК заключает в себе остаток повторяющейся единицы. Ее длина может варьировать in vivo от такого малого размера, как 8 п. н., до такого большого, как 114 п.н., на 1 нуклеосому.
Четко ограниченный размер полосы ДНК, образованной в результате первого расщепления нуклеазой микрококков, говорит о том, что область, непосредственно доступная для действия фермента, ограничена. К ней относится только часть каждого линкера. (Если бы вся линкерная ДНК была чувствительна, размер полосы колебался бы в интервале от 146 п.н. до отрезка, превышающего размер повторяющейся единицы). Но, после того как линкерная ДНК разрезана, оставшаяся часть становится чувствительной и довольно быстро расщепляется ферментом.
Хотя частицы минимальной нуклеосомы меньше, чем сами нуклеосомы, их свойства похожи. Они напоминают нуклеосомы по форме и размеру, из чего можно заключить, что основная геометрия такой частицы устанавливается в результате взаимодействия между ДНК и гистоновым октамером. Из-за того что минимальные частицы легче получить в виде гомогенного препарата, их использовали для многих структурных исследований вместо препаратов нуклеосом. Мономеры нуклеосом больше варьируют в размерах из-за того, что трудно получить препараты, в которых не происходило бы «подрезания» концов ДНК.
Какова физическая природа минимальной нуклеосомы (нуклеосомного кора) и линкера? Эти термины являются операциональными определениями для обозначения областей, относительно более и менее чувствительных к обработке нуклеазой. Из этого нельзя делать каких-либо выводов об их действительной структуре. Это не означает, в частности, что линкерная ДНК имеет более вытянутую форму. С другой стороны, путь ДНК в нуклеосоме может быть непрерывным без каких-либо четких различий между этими областями мономера. В действительности это условное рабочее предположение, которое часто делают, пытаясь перейти от структуры минимальной нуклеосомы к структуре нуклеосом. С другой стороны, возможно, что путь линкерной ДНК отличается от пути ДНК в минимальной нуклеосоме, о чем свидетельствуют заметные вариации, в длине линкеров.
Существование линкерной ДНК обеспечивается каким-то другим фактором, а не четырьмя гистонами сердцевины (гистонового кора). Эксперименты по реконструкции in vitro показывают, что гистонам присуща способность организовывать ДНК минимальной нуклеосомы, но не полную нуклеосому, длина ДНК в которой характерна для состояния in vivo. В этот процесс должны быть включены гистон H1 и (или) негистоновые белки, которые связаны с гистоновым октамером в природных сериях нуклеосом. Первичная реакция может зависеть от «белков сборки», которые участвуют in vivo в образовании нуклеосом из гистонов и ДНК, но которые не становятся частью нуклеосомной структуры (см. ниже).
Мы уже говорили, что гистон H1 теряется при деградации мономерных нуклеосом. Он еще остается в мономерах, содержащих 160-170 п.н. ДНК, но всегда теряется при последующем уменьшении до минимальной хромосомы размером 146 п.н. На основании этого факта можно предположить, что гистон H1 располагается в области линкерной ДНК, непосредственно прилегающей к ДНК минимальной нуклеосомы.
Два типа данных независимо говорят о том, что ДНК, очевидно, лежит на поверхности нуклеосомы, обвиваясь снаружи вокруг гистонового октамера. Согласно биофизическим данным, диаметр белкового компонента нуклеосомы меньше, чем диаметр витка ДНК. Биохимические данные показывают, что ДНК чувствительна к нуклеазам в участках, расположенных через определенные интервалы (см. ниже).
Нуклеосомы имеют в основном форму эллипса. Отношение осей равно 0,5 и соответствует размерам 11 х 11 х 6 нм. По своей форме нуклеосома обычно представляет собой плоский цилиндр диаметром 11 нм и высотой 6 нм. Даже на основе измерений кажется вероятным, что ДНК лежит снаружи. Окружность частицы, составляющая примерно 34 нм, сравнима с длиной ДНК - 67 нм (200 п. н.). Трудно представить, каким образом ДНК могла бы втиснуться в такую частицу.
Свойства отдельных компонентов можно измерить с помощью рассеяния нейтронов. Этот метод позволяет различить рассеяние, обусловленное ДНК, от рассеяния, обусловленного белком. Измерения показали, что белковый компонент (гистоновый октамер) имеет радиус вращения около 3,2 нм, но радиус вращения ДНК-компонента составляет примерно 5,2 нм. Разница в 2 нм соответствует диаметру двойной спирали ДНК. На основе этих данных было высказано предположение, что белок организован в компактное тело, вокруг которого намотана ДНК. Существуют различные модели, описывающие способ укладки ДНК в нуклеосоме. Наиболее общими чертами всех моделей является то, что структура должна быть симметричной и что ДНК проходит вокруг октаме-ра дважды. На рис. 29.7 схематически изображена ДНК, лежащая в виде двух витков спирали. Из этой схемы следует, что ДНК «входит» и «выходит» из нуклеосомы в точках, близко расположенных друг к другу. Однако до сих пор не уделяется достаточно внимания вопросу о том, с помощью какой модификации в укладке можно объяснить вариации длины ДНК в нуклеосоме.
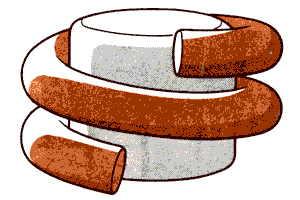
Рис. 29.7. Нуклеосому можно представить в виде цилиндра с двумя витками ДНК, закрученными снаружи вокруг него.
Рассматривая модель, изображенную на рис. 29.8 в виде поперечного сечения, можно видеть, что два витка ДНК лежат близко один к другому. Это, возможно, имеет функциональное объяснение. Один виток вокруг нуклеосомы захватывает 80 п.н., так что точки, отстоящие на это расстояние в свободной двойной спирали, могут оказаться расположенными достаточно близко друг к другу на нуклеосоме. Таким образом, если ДНК-связывающий белок одновременно контактирует с двумя витками ДНК, как показано на рис. 29.9, узнаваемые им последовательности могут отстоять на двойной спирали ДНК гораздо дальше, чем величина соединяющего их участка в белке. Часто обсуждается вопрос о том, может ли стартовая точка транскрипции находиться поблизости от положения — 80 так чтобы обе цепи одновременно контактировали с РНК-полимеразой. (Это внесло бы конкретную деталь в обобщенную модель, показанную на рис. 11.8).
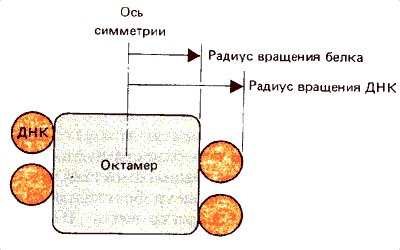
Рис. 29.8. Два витка ДНК в нуклеосоме должны лежать совсем близко друг к другу.

Рис. 29.9. Через белок может осуществляться контакт последовательностей ДНК, находящихся в различных витках на нуклеосоме.
Плотность упаковки отдельной нуклеосомы равна примерно 6 (так как 67 нм ДНК упакованы в частицу длиной около 11 нм). Можно упаковать серию нуклеосом достаточно плотно, чтобы сохранить это отношение. Множество работ по изучению наборов нуклеосом было выполнено на вирусе SV40. ДНК вируса SV40 представляет собой кольцевую молекулу в 5200 п.н., контурная длина которой равна примерно 1500 нм. И в состоянии вириона, и будучи инъецированной в ядро, она упакована в серию нуклеосом. В этой форме ее называют мини-хромосомой. При обычном выделении контурная длина мини-хромосомы равна примерно 210 нм, а плотность ее упаковки составляет примерно 7. Изменение в концентрации соли может превратить ее в гибкую нитку бус со значительно более низкой плотностью упаковки. Из этого следует, что нуклеосомные нити in vitro в зависимости от условий могут находиться в более чем одной форме.
Важным параметром в описании структуры хроматина является степень суперспирализации, которая может возникнуть на нескольких уровнях. Во-первых, суперспирализация может быть результатом упаковки ДНК на нуклеосоме. Во-вторых, суперспирализация может быть следствием укладки нуклеосом в структуру более высокого уровня. Состояние суперспирализации во многом может удерживаться белками (по принципу, описанному в гл. 28). Прямые измерения плотности суперспирализации позволят узнать среднее напряжение скручивания ДНК, возникающее в результате образования свободных супервитков, но таким образом нельзя обнаружить суперспирализации, которая удерживается в ходе упаковки ДНК.
Для мини-хромосомы вируса SV40 можно прямо измерить степень суперспирализации в самой нуклеосоме. Мини-хромосома может иметь свободные супервитки в гирлянде нуклеосом, а также супервитки, удерживаемые на нуклеосоме. Процедура измерения суперспирализации, обусловленная только структурой нуклеосом, показана на рис. 29.10. Сначала освобождаются свободные супервитки самой мини-хромосомы, так что гирлянда нуклеосом образует кольцо с нулевой суперспирализацией. Затем экстрагируют гистоновые октамеры. В результате этой процедуры освободившаяся ДНК свободно расправляется. Таким образом каждый супервиток, который сдерживается в мини-хромосоме, проявится в депротеинизированной ДНК как — 1 оборот. Так можно измерить общее число супервитков в ДНК вируса SV40.
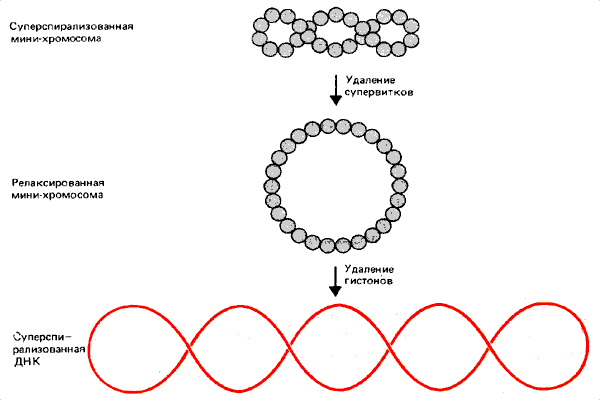
Рис. 29.10. Супервитки мини-хромосомы могут релаксировать и превратиться в кольцевую структуру, которая после удаления гистонов образует суперспирализованную свободную ДНК.
Действительно, наблюдаемое значение близко к числу нуклеосом. Противоположный результат наблюдают при сборке нуклеосом in vitro на суперспирализованной ДНК SV40: образование каждой нуклеосомы удаляет ~ 1 отрицательный супервиток. Таким образом, если удалить удерживающий белок, то ДНК, уложенная на поверхности нуклеосомы, образует ~ 1 отрицательный супервиток. Следует отметить, что существует потенциальное расхождение между измеренным значением, равным — 1 оборот на нуклеосому, и моделью, согласно которой укладка ДНК в нуклеосоме эквивалентна — 2 сверхспиральным оборотам (см. ниже).
Ферменты ДНКаза I и ДНКаза II вносят одноцепочечные разрывы в ДНК. Это означает, что они разрывают связь в одной цепи, тогда как вторая цепь остается в этом месте интактной. В результате цепь в целом кажется непрерывной, однако при денатурации вместо цепей обычной длины высвобождаются более короткие фрагменты (рис. 29.11).
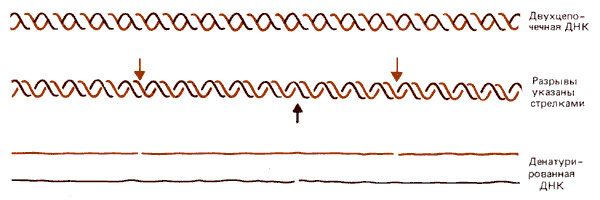
Рис. 29.11. Одноцепочечные разрывы (ники) в двухцепочечной ДНК обнаруживают по образованию фрагментов после денатурации ДНК и образования отдельных цепей.
Если ДНК находится в растворе, одноцепочечные разрывы (ники) возникают случайно. В ДНК, находящейся на нуклеосомах, такие разрывы могут быть образованы с помощью ферментов, но только в определенных точках. Разрывы образуются через определенные промежутки так, что при электрофорезе денатурированной ДНК получается лестница. В экспериментах этого типа фрагменты денатурированной ДНК могут соответствовать расстоянию от конца нуклеосомы до места разрыва или могут быть образованы в результате двух внутренних разрывов. Настоящие точки разрыва можно установить, используя концевую радиоактивную метку с последующей радиоавтографической идентификацией фрагментов. Как показано на рис. 29.12, будут обнаружены только фрагменты с концевой меткой. (Этот метод аналогичен методу секвенирования, показанному на рис. 3.4, или методу отпечатков - рис. 11.4.)
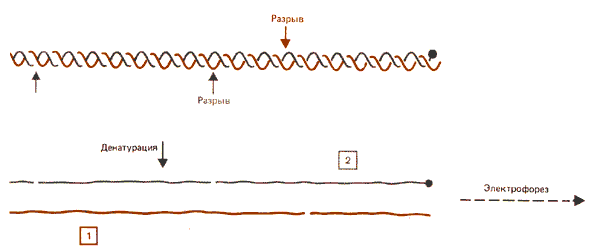
Рис. 29.12. С помощью метода концевого мечения определяют расстояние от одноцепочечных разрывов до меченых концов.
Лестница, полученная в результате обработки ДНКазой I, показана на рис. 29.13. Похожие результаты получают при аналогичной обработке хроматина. (Действительно, для таких экспериментов in vitro обычно используют препарат минимальных нуклеосом, так как трудно получить препараты полных нуклеосом с гомогенным распределением по размеру фрагментов ДНК.) Интервал между последовательными ступенями лестницы составляет примерно 10 оснований. Лестница вытягивается на всю длину ДНК минимальной нуклеосомы; сайты расщепления пронумерованы от S1 до S13 (где S1 расположен через ~ 10 оснований от меченого 5'-конца ДНК, S2-через ~ 20 оснований и т. д.). Из этого следуют два важных вывода. Во-первых, ДНК не защищена на нуклеосоме и остается чувствительной к ДНКазе I; она не «покрыта» белками. Во-вторых, чувствительные участки расположены периодически.
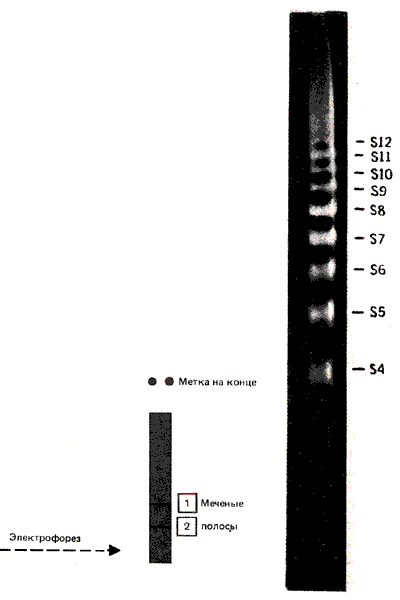
Рис. 29.13. На электрофореграмме ядерного гидролизата, образованного под действием ДНКазы I, видно, что сайты одноцепочечных разрывов располагаются на ДНК минимальной нуклеосомы через определенные интервалы. (Фотография любезно предоставлена Leonard Lutter.)
Не все участки разрезаются с одинаковой частотой: некоторые разрезаются достаточно эффективно, а другие совсем редко. Ферменты ДНКаза I и ДНКаза II образуют одинаковую лестницу, хотя с некоторыми различиями в интенсивности полос. Это говорит о том, что картина разрезания обусловлена уникальной серией мишеней в ДНК, определяемых ее организацией. Отдельные ферменты имеют только слабое предпочтение к определенному сайту в этой мишени.
Поскольку в минимальной нуклеосоме находятся две цепи ДНК, метка вводится в оба 5'-конца (или З'-конца), так что метится один конец каждой цепи. Поэтому при разрезании образуются фрагменты, относящиеся к обеим цепям. Это изображено на рис. 29.12, где каждый фрагмент происходит из разных цепей. В таком эксперименте каждая меченая полоса в действительности представляет собой два фрагмента, отрезанные на одном и том же расстоянии от любого из меченых концов. Как же тогда можно объяснить дискретное предпочтение определенных сайтов? Обычная точка зрения заключается в том, что фермент действует симметрично на обе цепи. Таким образом, если, например после обработки ДНКазой I не образуется фрагмента в 80 п. н., это должно означать, что положение, соответствующее 80-му основанию с 5'-конца любой из цепей, нечувствительно к ферменту.
Какова природа участков-мишеней? Первый вопрос, который нужно решить, - это взаимоотношение между сайтами разрезания на двух цепях ДНК. Это удалось выяснить, используя условия, при которых фермент образует двухцепочечные разрезы. Исследуя концы образовавшихся двухцепочечных фрагментов, можно понять взаимоотношение между разрезами, сделанными на двух разных цепях. Результаты такого исследования суммированы на рис. 29.14.
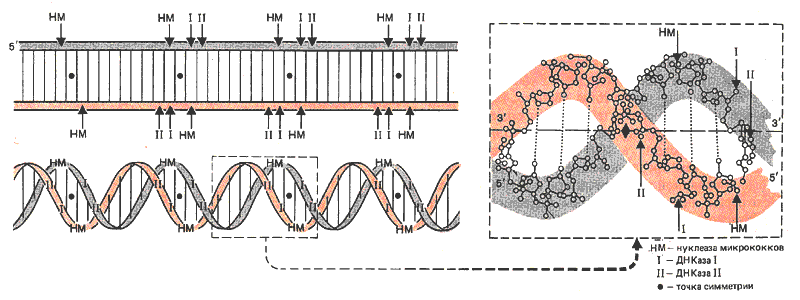
Рис. 29.14. Каждая нуклеаза разрезает ДНК на определенном расстоянии между сайтами на обеих цепях.
Фермент ДНКаза I разрезает две цепи на расстоянии 2 п.н. Фермент ДНКаза II разрезает их на расстоянии 4 п. н. По отношению к точке симметрии разрез, сделанный ДНКазой I, отклоняется на одно основание в сторону З'-конца, а ДНКаза II делает разрез, отступя на два основания в направлении З'-конца. Нуклеаза микрококков делает один разрез в обеих цепях, отступя на одно основание в направлении 5'-конца. Вероятнее всего, что все ферменты узнают одну и ту же точку, но разрезают ДНК на определенном расстоянии от этой точки, определяемом индивидуальной геометрией ферментов.
Наиболее существенный вывод, который можно сделать из этих результатов, состоит в следующем: сайт разрезания представляет собой короткий отрезок (порядка 3-4 пар оснований), в котором фосфодиэфирные связи в обеих цепях открыты для действия нуклеазы. Аналогичный вывод был сделан при детальном исследовании в гелях высокого разрешения фрагментов одной цепи с концевой меткой, полученных при разрезании минимальной нуклеосомы ДНКазой I или II. Пример такого эксперимента показан на рис. 29.15. В каждом сайте действительно существуют 3-4 положения, в которых может произойти разрез, т.е. сайт разрезания определяется с точностью +1 п. н. Относительная интенсивность разрезания указывает на то, что некоторые положения оказываются предпочтительнее других. На основе полученной картины можно подсчитать «среднюю» точку разрезания. При этом видно, что нуклеотидные пары сайтов от S1 до S4 лежат на расстоянии 10,0 п.н. друг от друга, сайты от S4 до S10 разделены на 10,7 п.н., а для сайтов от S10 до S13 расстояние снова становится равным 10,0 п.н. (Поскольку мы анализируем среднее положение, сайты оказываются разделены не целым числом оснований.)

Рис. 29.15. Высокоразрешающий анализ показывает, что каждый сайт для ДНКазы I состоит из нескольких соседних чувствительных фосфодиэфирных связей, как это видно на представленном примере сайтов S4 и S5 в ДНК частиц минимальной нуклеосомы, исследованных с введением концевой метки. (Фотография любезно предоставлена Leonard Lutter.)
Эксперименты, в которых анализируют ДНК на нуклеосомах по ее чувствительности к нуклеазам, проводят по методу, близкому к методу отпечатков (footprint). Таким образом, мы можем связывать утрату реакции в определенном сайте-мишени с такой структурой нуклеосомы, в которой данные положения на ДНК стали нечувствительными. Но какова причина периодического разрезания через 10,7 п.н.?
Эта периодичность близка к периодичности В-формы ДНК. Означает ли это, что повторяемость чувствительного сайта просто отражает иммобилизацию ДНК на гистоновом октамере? Это может происходить так, как изображено на рис. 29.16, где пик чувствительных сайтов встречается в каждой цепи с периодичностью, определяемой числом пар оснований на виток двойной спирали.
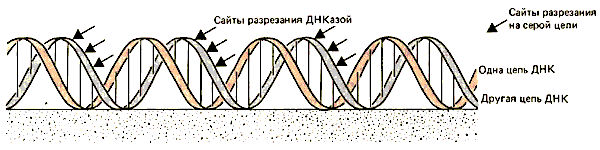
Рис. 29.16. Большинство открытых положений в ДНК повторяется с периодичностью, отражающей структуру двойной спирали (для четкости показаны только сайты в одной цепи).
Некоторый свет на этот вопрос может пролить сравнительный анализ ДНК, иммобилизованной на плоской поверхности (ситуация, рассмотренная на рис. 29.16). В этом случае сайты нарезаются на расстоянии ровно 10,6 п.н. Это, вероятно, означает, что свободная ДНК (т. е. выделенная в растворе), имеет двуспиральную структуру В-типа, у которой повторяющаяся длина равна 10,6 п.н. С помощью измерения числа пар на виток, выполненных другим методом, получено очень близкое значение -10,4 п. н.
Мы считаем, что при иммобилизации ДНК на плоской поверхности периодичность разрезания (расстояние между точками расщепления) действительно соответствует структурной периодичности (число пар на виток двойной спирали). Вариации в периодичности разрезания ДНК минимальной нуклеосомы (10,0 на концах и 10,7 посередине) затрудняют интерпретацию этого явления. Одно из предположений заключается в том, что структурная периодичность ДНК минимальной нуклеосомы действительно варьирует. В средней части она более близка к В-форме, а на концах может быть закручена слабее. Другая возможность состоит в том, что сама ДНК имеет постоянную периодичность, но геометрия нуклеосомы вызывает смещение мест разрезания в средней части. Если в некоторых положениях доступ ферменту ограничен, он может изменить свой выбор среди 3-4 доступных связей. В этом случае периодичность разрезания не будет соответствовать структурной периодичности.
Если это так, то что такое структурная периодичность? При отсутствии необходимых данных нужно построить модель, для того чтобы увидеть, какое из предположений может обеспечить доступ фермента к ДНК. Идеи о меняющейся структурной периодичности или о фиксации расстояния в 10,6 п.н. оказываются менее подходящими, чем предположение о существовании в нуклеосоме постоянной периодичности с 10,0 п. н. на виток.
Некоторые интересные выводы вытекают из данных, дающих основание думать, что структурная периодичность ДНК в нуклеосоме (10,0) и ДНК в растворе (10,6) может быть различной. При освобождении ДНК из нуклеосомы она должна становиться более скрученной, так как у нее больше пар оснований на виток. Это изменение уменьшит степень ее суперспирализации. Предположим, что ДНК проходит в нуклеосоме путь, равный двум оборотам суперспирали. Затем удалим гистоновый октамер. Некоторое напряжение скручивания приведет к большему закручиванию ДНК, и только остаточное напряжение должно измеряться как суперспиральное. Это один из возможных способов согласовать модели для — 2 суперспиральных витков на нуклеосоме с данными, в которых определен только — 1 супервиток. Поскольку различие в периодичности (0,6 на оборот спирали), умноженное на число супервитков, приходящихся на нуклеосому ( > 15), примерно равно 10 п.н. и соответствует одному обороту двойной спирали, то таким образом есть потенциальная возможность поглотить 1 отрицательный супервиток.
И еще одно важное замечание нужно сделать относительно укладки ДНК в нуклеосоме и ее возможной степени суперспирализации. Все обсуждавшиеся данные были получены с использованием препаратов минимальной нуклеосомы. В моделях, объясняющих противоречивость данных о числе супервитков, предполагается, что линкерная ДНК уложена таким же способом, что и ДНК минимальной нуклеосомы. Однако способ укладки линкерной ДНК может быть иным. Анализ «лестниц», полученных при расщеплении ДНКазой I фрагментов длиной более 1000 п. н., свидетельствует в пользу того, что выходящая из кора ДНК уложена так же, как и ДНК кора. Это означает, что одна и та же периодичность разрезания сохраняется не только в отдельной нуклеосоме, но и между нуклеосомами. Другими словами, ДНК следует от одной нуклеосомы к другой, не нарушая способа организации, по крайней мере насколько это видно из периодичности разрезания.
До сих пор мы рассматривали конструкцию нуклеосомы, исходя из того, как организованы повторяющиеся единицы длины ДНК на поверхности нуклеосом. Если же исходить из организации белка в нуклеосоме, то нужно знать, каким образом гистоны взаимодействуют друг с другом и с ДНК. Взаимодействуют ли гистоны только в присутствии ДНК или способны независимо собираться в октамеры?
Мы еще многого не знаем о структуре индивидуальных гистонов в нуклеосоме, но уже стала проясняться их относительная локализация. Большинство данных о взаимодействиях гистонов получено при изучении способности к агрегированию и к образованию перекрестных сшивок в нуклеосоме.
Способность гистонов агрегировать друг с другом изучена хорошо. Гистоны, богатые аргинином, можно получать в виде хорошо различимого тетрамера (Н32Н42). Гистоны, умеренно богатые лизином, образуют продукт, который менее четко охарактеризован, но который, очевидно, образует димер (Н2А • Н2В), имеющий тенденцию к дальнейшей агрегации. Одной из форм образующегося агрегата может быть тетрамер (Н2А2 • Н2В2). Два указанных тетрамера называют гомотипическими (название отражает то, что каждый из них содержит только гистоны, относящиеся к одному из исходных классов).
Интактные октамеры гистонов можно получить либо экстракцией хроматина, либо (с большими трудностями) путем соединения гистонов in vitro в условиях высокой концентрации соли и белка. Октамер может диссоциировать с образованием гексамера гистонов и свободного димера Н2А • Н2В. В результате отделения второго димера Н2А • Н2В образуется тетрамер Н32Н42. Все эти формы можно экстрагировать из хроматина. Исходя из этих данных, можно сделать вывод, что в нуклеосоме имеется центральное «ядро» (kernel), состоящее из тетрамера Н32Н42, связанного с двумя независимыми димерами Н2А • Н2В.
Перекрестные сшивки позволяют установить, какие пары гистонов лежат ближе друг к другу в нуклеосоме. (Сложность в интерпретации этих данных заключается в том, что сшивается только небольшая часть гистонов. Поэтому следует оценивать результаты с осторожностью, учитывая типичность большинства взаимодействий.) На основе полученных данных была сконструирована модель организации нуклеосомы. В достаточно схематичной форме она изображена на рис. 29.17.
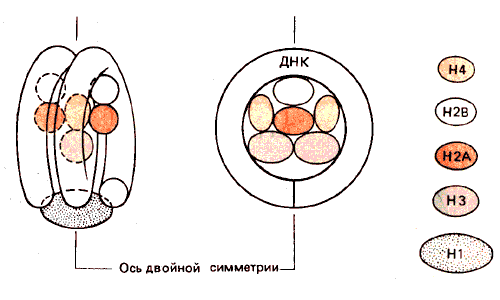
Рис. 29.17. Модель нуклеосомы спереди и сверху. Видна симметричность конструкции с сердцевиной из тетрамера Н32Н42.
Структурные исследования показывают, что по своей общей форме изолированный гистоновый октамер похож на минимальную нуклеосому. Из этого следует, что общая структура зависит от гистон-гистоновых взаимодействий. Положение индивидуальных гистонов в структуре октамера было установлено на основе их способности к агрегированию и к образованию поперечных сшивок.
Диаметр всего октамера определяется размером тетрамера Н32Н42. Этой особенностью объясняется способность тетрамера in vitro организовывать ДНК в частицы, проявляющие некоторые свойства минимальной нуклеосомы (см. ниже). Белки располагаются в тетрамере так, что их порядок отвечает наблюдаемым поперечным сшивкам: НЗ-Н4 и НЗ-Н4. Пары Н2А-Н2В присоединяются в виде двух димеров. ДНК дважды обматывается вокруг октамера. Гистон H1 может «запечатывать» ДНК в нуклеосоме, связывая ее в точке, где сближаются входящая и выходящая нити. Этим объясняется способность гистона H1 образовывать поперечные связи с гистоном НЗ. Описанная модель имеет симметрию второго порядка.
Несмотря на то что общая форма октамера теперь определена достаточно точно (хотя на рисунке этого не видно), индивидуальные гистоны изображены на рисунке в виде аморфных шариков, поскольку мы не располагаем данными об их структуре. Распределение аминокислот на N-конце, несущем большой заряд, одинаково у всех гистонов. Остальная часть молекулы содержит гидрофобные аминокислоты, которые, вероятно, образуют глобулярную структуру и участвуют в белок-белковых взаимодействиях. По этой причине гистоны иногда воспринимаются как глобулярные белки с заряженными N-концевыми «хвостами». Можно было бы думать, что у «хвостов» преобладает ДНК-связывающая активность, тогда как глобулярные области входят внутрь сердцевины. Однако против этой модели свидетельствуют данные о том, что N-концевые области можно отщепить (обработав трипсином) от гистонов сердцевины, не вызывая при этом сколько-нибудь существенных нарушений структуры нуклеосомы. Кроме того, гистоны без N-концевых «хвостов» могут участвовать в сборке нуклеосомы in vitro. В настоящий момент мы не можем приписать индивидуальных функций определенным участкам гистоновых молекул.
Гистоны сердцевины обладают способностью накручивать ДНК вокруг белкового октамера. Однако существует несколько способов, посредством которых ДНК может связаться с гистонами.
Первоначально реконструкцию нуклеосом in vitro можно было осуществить только в условиях, далеких от физиологических; отдельные компоненты смешивали при высокой концентрации солей и мочевины, которые потом удаляли с помощью диализа. Но теперь реакцию частично контролируют, регулируя последовательность добавления гистонов и ДНК и их относительную концентрацию. В этом случае самосборка происходит в условиях, близких к физиологическим. Процесс этот, медленный сам по себе, еще и ограничивается тенденцией собирающихся частиц к преципитации. Два возможных способа сборки нуклеосом показаны на рис. 29.18.
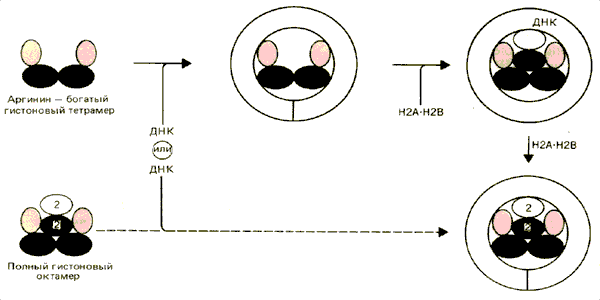
Рис. 29.18. В определенных условиях in vitro ДНК может связываться с тетрамером Н32Н42, к которому присоединяются два димера Н2А • Н2В. В других условиях ДНК может прямо взаимодействовать с интактным гистоновым октамером (содержащим перекрестные сшивки).
Один из них обусловлен способностью тетрамера Н32Н42 организовывать ДНК в частицы, которые несколько напоминают минимальную нуклеосому (по их чувствительности к нуклеазе микрококков). При добавлении димера Н2А • Н2В эти тельца могут превращаться в минимальную нуклеосому. Именно отсюда возникла идея о том, что в структуре нуклеосомы существует «ядро» из аргинин-богатых гистонов. Возможно, такой путь используется in vivo, поскольку это согласуется с наблюдением, что гистоны НЗ и Н4 включаются в реплицирующийся хроматин, до того как в его состав входят гистоны Н2А и Н2В.
Другие данные были получены при использовании поперечно-сшитых гистоновых октамеров, которые не могут диссоциировать на отдельные белки, но тем не менее сохраняют способность связывать ДНК с образованием минимальной нуклеосомы. Это говорит о том, что в принципе ДНК может обвиваться вокруг предварительно сформированного октамера.
Далее было сделано допущение, что благодаря своей симметричной структуре нуклеосома, возможно, разделяется на две «полунуклеосомы». С этой точкой зрения согласовывалось наблюдение о том, что мини-хромосома вируса SV40 способна изменять свою структуру при низкой концентрации соли. При этом образуется вдвое больше бусинок, каждая из которых меньше по размеру, чем нуклеосома. Могут ли они быть полунуклеосомами, состоящими из гетеротипичного тетрамера (Н2А • Н2В • НЗ • Н4)? Могут ли такие промежуточные формы использоваться при репликации хроматина, соединяясь с другим набором из четырех гистонов для восстановления полной нуклеосомы, как это гипотетически представлено на рис. 29.19?
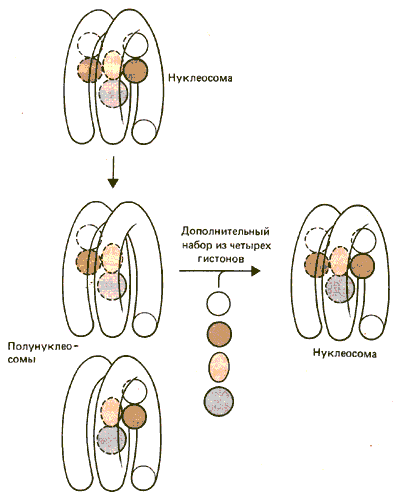
Рис. 29.19. Может ли нуклеосома разделяться на две полунуклеосомы (гетеротипические тетрамеры), которые могут стать полными нуклеосомами путем добавления второго гетеротипического тетрамера гистонов?
При попытке собрать нуклеосомы in vitro процесс сборки в основном рассматривают как соединение свободной ДНК с гистонами. Но в действительности in vivo хроматин репродуцируется. Отрезок ДНК, уже связанный с нуклеосомами, реплицируется, давая начало двум дочерним дуплексам. Что происходит в этот момент с предсуществующими нуклеосомами? Диссоциируют ли гистоновые октамеры на свободные гистоны, которые затем вновь собираются, или же они остаются в собранном виде? Некоторые такие возможности показаны на рис. 29.20.
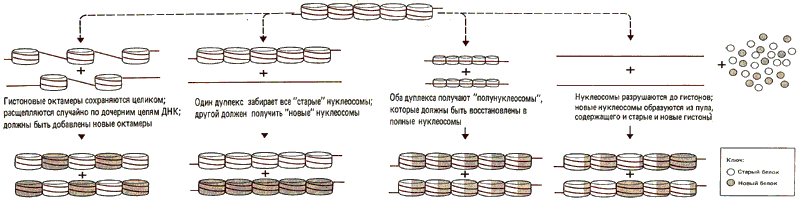
Рис. 29.20. Существует много возможных вариантов поведения нуклеосом при репликации ДНК.
Эксперименты с использованием поперечных сшивок говорят о том, что гистоновый октамер может быть консервативным, сохраняясь целиком на протяжении всего цикла репликации. Остаются ли «старые» октамеры связанными в каком-либо определенном порядке с дуплицированными ДНК? Например, все ли старые октамеры остаются на одном дочернем дуплексе, тогда как «новые» октамеры собираются на другом. Однако, если предотвращена сборка новых гистонов (например, путем подавления синтеза белка циклогексимидом), «старые» октамеры разделяются между обоими дочерними дуплексами.
Таким образом нуклеосомы могут образовываться двумя способами. При репликации хроматина уже находящиеся на нем гистоновые октамеры удаляются с ДНК, что делает возможным репликацию. Эти октамеры сохраняются и могут реассоциировать с любым из дочерних дуплексов. Однако такое же число октамеров должно быть образовано из новосинтезированных гистонов. Происходит ли сборка этих октамеров также раньше, чем они связываются с ДНК или же наоборот, в данном случае они собираются на ДНК? Или, может быть, октамеры распределяются случайно между дочерними дуплексами? Эксперименты, поставленные для выяснения этого вопроса, не дали однозначного ответа, поскольку трудно отличить заново реплицированный материал от массы пред-существовавшего хроматина.
Очевидно, что в процессе редупликации хроматина ДНК не остается свободной от нуклеосом в течение сколько-нибудь продолжительного периода. Как только ДНК реплицируется, нуклеосомы сразу образуются на обеих репликах независимо от того, каков точный механизм процесса. Это проиллюстрировано на электронной микрофотографии (рис. 29.21), на которой показано, что у только что реплицированного отрезка ДНК оба дочерних дуплекса уже усыпаны нуклеосомами.
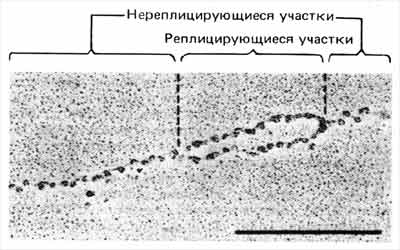
Рис. 29.21. Реплицированные участки хроматина содержат нуклеосомы в обоих дочерних дуплексах ДНК. (Фотография любезно предоставлена Steven L. McKnight.)
Структура участка, в котором непосредственно происходит репликация ДНК, отличается от других областей. Этот участок более устойчив к нуклеазе микрококков и при ферментативном расщеплении образует полосы, отличающиеся по размеру от нуклеосомной ДНК. Следовательно, можно предположить, что в репликации ДНК участвует достаточно большой белковый комплекс, причем почти сразу после того, как он передвигается дальше, восстанавливается нуклеосомная структура.
В состав хроматина входят как нуклеосомные гистоны, так и негистоновые белки, и все эти дополнительные компоненты должны репродуцироваться. Поскольку комплект негистоновых белков, по-видимому, варьирует в зависимости от конкретного фенотипа клетки, при его репликации сохраняются особенности клеточной специфичности. Таким образом, возможность существования механизма сегрегации белков в процессе репликации ДНК имеет значение, выходящее за рамки вопроса о сборке нуклеосом. Одним из наиболее принципиальных вопросов, на который хотелось бы ответить, является вопрос о том, каким образом различные состояния структуры хроматина наследуются дочерними клетками.
Рассмотрим ген, который активирован (или репрессирован) путем связывания с ДНК какого-то специфического регуляторного белка и (или) каким-то изменением структуры хроматина. Каким путем это конкретное состояние будет унаследовано дуплицированными хромосомами дочерних клеток, образовавшихся в результате деления? Если во время репликации все белки отделяются от ДНК, специфическое состояние должно заново устанавливаться в каждом цикле клетки. Однако возможно, что определенный механизм сегрегации используется для того, чтобы передать информацию о состоянии экспрессии генов. Одна возможность заключается в том, что специфическая структура может быть увековечена путем сегрегации и дупликации в процессе репликации ДНК. Например, образец, формально эквивалентный полунуклеосомной сегрегации, показан на рис. 29.20 (безотносительно к тому, используется ли такой тип сегрегации самими гистонами). Таким образом, комплекс негистоновых белков может сформироваться на ДНК, затем расщепиться на полукомплексы при репликации и вновь достроиться до полных комплексов на каждом дочернем дуплексе.
Общая структура хроматиновой нити может играть важную роль в сборке хроматина. Если в ооцит инъецировать кольцевую ДНК, в нем происходит сборка первых нуклеосом и затем нить становится суперспирализованной. Эти свойства можно воспроизвести в системе in vitro, содержащей АТР в качестве источника энергии, необходимой для суперспирализации. При такой «активной сборке» образуются нуклеосомы с периодичностью 200 п.н. Выделив эту систему в очищенном виде, мы можем определить взаимодействия, участвующие в определении длины ДНК, соответствующей каждой нуклеосоме.
Другая сторона этой проблемы заключается в том, каким образом происходит изменение типа генной экспрессии. Чаще всего возможность изменений связывают с процессом репликации ДНК, во время которого временно нарушается структура хроматина. Однажды случившееся изменение может наследоваться с помощью механизма сегрегации до тех пор, пока не произойдет другого изменения (см. также гл. 30).
В хроматине, образованном в ооците путем активной сборки, содержится материал двух типов, различающийся по чувствительности к нарушению суперспирализации. Большая часть хроматина содержит закрепленные супервитки. Они остаются после введения одноцепочечных разрывов и снимаются только после удаления гистонов.
Однако часть хроматина (до ~ 30%) находится в напряженном состоянии. В нем есть супервитки, которые можно снять, вводя одноцепочечные разрывы. В этой фракции содержатся транскрибирующиеся последовательности. Суперспирализованная область может совпадать с доменами, ранее обнаруженными в целых геномах (см. гл. 28). Пока мы еще не знаем, чем обусловлены различия между двумя этими типами хроматина.
В результате экспериментов по реконструкции ДНК с гистонами образуется структура, более напоминающая частицу минимальной нуклеосомы, чем полную нуклеосому. При низких концентрациях, когда отдельные сформированные частицы соединены нитью ДНК, более 146 п.н. связываются с белковым октамером. Но это не постоянная характеристика, поскольку при увеличении концентрации, приводящей к более плотной упаковке частиц, каждый октамер оказывается связанным только со 146 п.н. ДНК, т.е. отрезком ДНК, равным по размеру ДНК минимальной нуклеосомы. Это выглядит так, как будто в отсутствие соседней минимальной нуклеосомы гистоновый октамер старается захватить больше ДНК, но при появлении ближайшего соседа отдает всю ДНК, за исключением той ее части, которая входит в состав собственной минимальной нуклеосомы.
Что же отвечает за модуляцию этой реакции in vivo, влияющей на расположение нуклеосом с интервалом, специфическим для соответствующего генома или даже для отдельных его частей?
Единственной системой, в которой удалось получить аутентичную плотность расположения нуклеосом в опытах по реконструкции, оказалась система ооцитов Xenopus. При инъецировании ДНК вируса SV40 в ооциты кольцевые молекулы могут формировать мини-хромосомы. При достаточном избытке ДНК пул эндогенных гистонов истощается и сборка начинает зависеть от введения дополнительных гистонов. Характерные признаки системы сохраняются в бесклеточном экстракте, где сборка нуклеосом на свободной ДНК происходит с интервалом в 195 п.н. Это важная информация, так как она показывает, что правильная сборка нуклеосом может происходить de novo со свободной ДНК. Сборка не связана непременно с актом репликации; она не зависит от последовательности добавленной ДНК.
Эти признаки еще не были воспроизведены полностью во фракционированной системе реконструкции, но некоторый успех в идентификации отдельных компонентов был достигнут. Из ооцитов Xenopus выделен белок сборки. Это пентамер, содержащий идентичные субъединицы по 29000 дальтон. Это белок, преобладающий в ооцитах, и локализован он в нуклеоплазме. Антитела, полученные против этого белка, реагируют с белками нуклеоплазмы многих эукариот. Следовательно, можно предположить, что этот белок соответствует эволюционно какой-то универсальной функции, закрепленной в процессе эволюции. Он был назван нуклеоплазмином.
В присутствии нуклеоплазмина гистоны могут связываться с ДНК, образуя в физиологических условиях (низкая концентрация соли) частицы. При расщеплении этих частиц нуклеазой микрококков образуются полосы ДНК размером в 146 и 165 п.н. Отсюда следует, что некоторые из образованных минимальных нуклеосом содержат дополнительную ДНК, протяженность которой недостаточна для образования полных нуклеосом. Следовательно, нуклеоплазмин участвует в контроле реакции ДНК с гистонами таким образом, что этот процесс становится продуктивным и ведет к образованию нуклеосом, а не случайных агрегатов. Однако самого по себе нуклеоплазмина недостаточно для образования нуклеосом со специфическим интервалом.
Какова функция нуклеоплазмина? Это кислый белок, который не связывается ни со свободной ДНК, ни с интактными нуклеосомами, но при этом он связывается со всеми индивидуальными гистонами. Реакция насыщается на уровне, равном одному пентамеру нуклеоплазмина на октамер гистона. Нуклеоплазмин, возможно, играет роль «молекулярного сопровождающего», связываясь с гистонами и передавая их ДНК более регулируемым образом, чем было бы возможно без такого конкурента. В пользу этого предположения говорит тот факт, что кислая полиглутаминовая кислота, а также РНК могут действовать сходным образом в качестве факторов сборки.
Общая особенность всех этих факторов состоит в том, что все они способны связываться с гистонами, уменьшая суммарный положительный заряд. Использование высокой концентрации соли для сборки гистонового октамера in vitro имитирует эту ситуацию. В этой связи следует упомянуть также прежнюю идею о том, что модификация заряженных групп гистонов может быть использована для регуляции сродства данного белка к ДНК (гл. 30). В результате таких взаимодействий гистоны могут образовывать термодинамически более стабильные агрегаты, минуя этап кинетических промежуточных продуктов (т.е.других комплексов, возникающих в результате высокого сродства гистонов к ДНК).
Из этого следует, что в процессе сборки нуклеосомы должны выполняться по крайней мере две функции, не свойственные самим компонентам нуклеосом. Первая из них касается контроля сродства гистонов к ДНК; это функция нуклеоплазмина. Второй связан с установлением длины ДНК, которая содержится в нуклеосоме; эту функцию еще предстоит выяснить.
При исследовании хроматина под электронным микроскопом можно видеть два типа нитей: нити размером 10 нм и нити размером 30 нм. Это примерный диаметр нити (диаметр нити в 30 нм в действительности варьирует от 25 нм до 30 нм).
Нити размером 10 нм - это в основном непрерывный ряд нуклеосом. В действительности иногда они переходят в более вытянутые отрезки, на которых нуклеосомы имеют вид бусинок, нанизанных на нитку, как это показано на рис. 29.22. Нити размером 10 нм образуются в условиях низкой ионной силы в отсутствие гистона H1. Это означает, что образование данной структуры - функция самих нуклеосом.
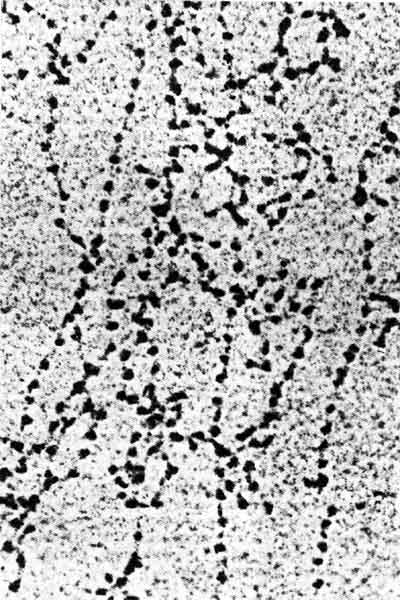
Рис. 29.22. Нить размером 10 нм в частично раскрученном состоянии представляет собой цепочку нуклеосом. (Фотография любезно предоставлена Barbara Hamkalo.)
Как расположены нуклеосомы в нитях размером в 10 нм? Рассматривая отдельную частицу как некий плоский цилиндр, можно расположить соседние цилиндры либо бок о бок, либо торцами друг к другу. Эти два способа расположения можно различить с помощью биофизических методов, таких, как рассеяние нейтронов или электрический дихроизм, который определяет ориентацию индивидуальных субъединиц относительно оси. На основе полученных результатов была предложена модель, изображенная на рис. 29.23. Согласно этой модели, цилиндры ориентированы бок о бок друг к другу, а их торцы расположены параллельно (по крайней мере не сильно отклоняются) к оси фибриллы. Полученные данные подразумевают, что максимальный угол между торцами и осью может быть около 20o.
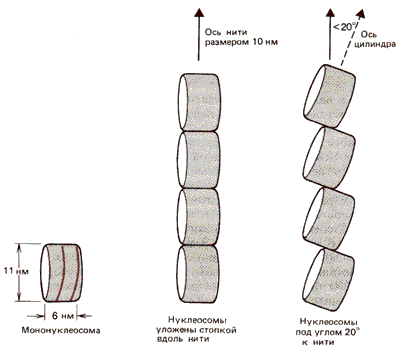
Рис. 29.23. Нить размером 10 нм состоит из серии нуклеосом, расположенных бок о бок стопкой вдоль нити или с наклоном менее 20o к оси.
Когда хроматин исследуют в условиях высокой ионной силы и в присутствии гистона H1, получают нити размером 30 нм. Такой пример показан на рис. 29.24. Видно, что фибриллы имеют спиральную структуру. Примерно 6 нуклеосом содержится в каждом витке, плотность упаковки которого равна 40 (т.е. на каждый 1 мкм оси нити приходится 40 мкм ДНК). Такие нити служат основным компонентом интерфазного хроматина и митотических хромосом (см., например, рис. 28.7).
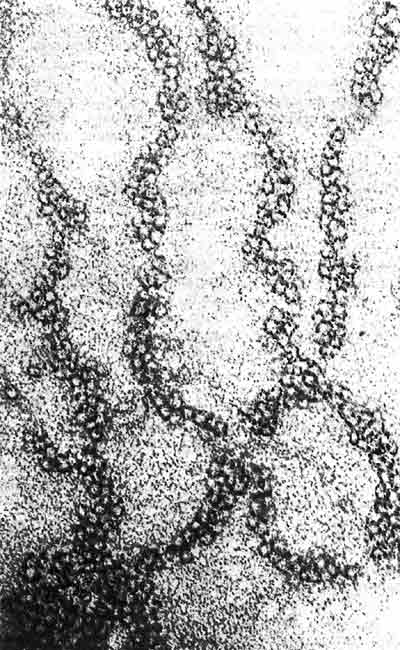
Рис. 29.24. Нить размером 30 нм имеет спиральную структуру. Эта нить показана при том же увеличении, что и нить размером 10 нм на рис. 29.22. (Фотография любезно предоставлена Barbara Hamkalo.)
Нити размером 30 и 10 нм могут обратимо превращаться друг в друга при изменении ионной силы. Отсюда, очевидно, следует, что при высокой ионной силе и в присутствии гистона H1 линейный ряд нуклеосом нити размером 10 нм закручивается в структуру толщиной 30 нм.
С другой стороны, существует несколько возможных способов упаковки нуклеосомы в нити. Наиболее вероятный способ описывается радиальной моделью, показанной на рис. 29.25. В этой модели нуклеосомы повернуты в спирально закрученном ряду, так что угол между торцами соседних нуклеосом составляет примерно 60o.
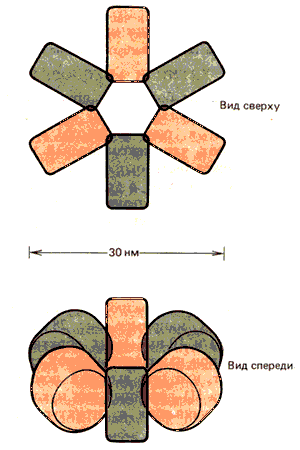
Рис. 29.25. Нить размером 30 нм может образовывать спиральный виток из 6 нуклеосом на виток, уложенных радиально.
Похоже на то, что параметры нити размером 30 нм не жестко фиксированы и могут изменяться. Это сделало бы возможным изменение длины ДНК на нуклеосому, а также другие изменения в плотности упаковки. Пока не известно, имеют ли нити одинаковой толщины одинаковую структуру в интерфазном хроматине и в митотических хромосомах.
Хотя известно, что для образования фибрилл размером 30 нм необходимо присутствие гистона H1, данные о его локализации противоречивы. Поскольку он относительно легко экстрагируется из хроматина, можно думать, что он расположен снаружи суперспиральной оси нити. Однако другие данные свидетельствуют о его внутренней локализации, поскольку он труднее обнаруживается в нитях размером 30 нм, чем в тех отдельных нитях размером 10 нм, в которых он не утрачен.
Как перейти от нити размером 30 нм к специфическим структурам митотических хромосом? Существует ли еще какая-нибудь специфичность в расположении интерфазного хроматина? Фиксировано ли расположение бусинок в отдельных участках нитей размером 30 нм, или они располагаются случайно? Пока на эти вопросы у нас нет ответа.
Интерфазный хроматин кажется запутанной массой, занимающей большую часть объема ядра, в противоположность высокоорганизованной и воспроизводимой ультраструктуре митотических хромосом. Что контролирует распределение интерфазного хроматина внутри ядра? Некоторые косвенные данные об организации интерфазного хроматина были получены при выделении генома в виде единого компактного тела. С помощью того же метода, который был использован для выделения бактериального нуклеоида (гл. 28), можно лизировать ядра, нанося их сверху на сахарозный градиент. При этом геном освобождается в такой форме, что его можно собрать центрифугированием. Геном, выделенный из D. melanogaster, представляет собой компактно скрученные нити размером 10 нм, состоящие из ДНК и четырех гистонов сердцевины.
Степень суперспирализации этого компактного тела можно измерить по его реакции на бромистый этидий (гл. 28). Полученные данные свидетельствуют о существовании примерно одного отрицательного супервитка на 200 п.н. Эти супервитки можно удалить, вводя одноцепочечные разрезы с помощью ДНКазы; нуклеосомы при этом остаются. Следовательно, суперспирализация, очевидно, обусловлена расположением нуклеосом и должна заключаться в скручивании линкеров между отдельными нуклеосомами. Для полной релаксации супервитков нужен один одноцепочечный разрез на каждые 85 т.п.н. Таким образом, средняя длина «замкнутой» ДНК равна примерно 85 т.п.н. Это может быть петля или домен, похожий по своему устройству на те, которые обнаружены в бактериальном геноме. Хотелось бы знать, соответствуют ли эти петли специфическим последовательностям и имеют ли они функциональное значение.
Если удалить большинство белков из митотических хромосом, то можно прямо наблюдать петли. Гистоны удаляют путем конкурентного замещения полианионами декстрансульфатом и гепарином. При этом также удаляется значительная часть негистоновых белков. Оставшийся комплекс состоит из ДНК, связанной с белком, который составляет примерно 8% от исходного содержания белков. Как видно из рис. 29.26, хромосомы, лишенные белка, приобретают характерную структуру в виде центрального остова, окруженного ореолом из ДНК.

Рис. 29.26. Лишенная гистонов хромосома состоит из белкового остова, к которому прикреплены петли ДНК. (Фотография любезно предоставлена Ulrich К. Laemmli.)
Остов состоит из плотной сети хроматиновых нитей. Нити ДНК, исходящие из остова, выглядят как петли, длина которых в среднем составляет 10-30 мкм (30-90 т. п. н.). Если для того, чтобы уместиться в нити размером 30 нм, петли должны быть уплотнены в 40 раз, то их средняя длина будет около 0,25-1,0 мкм, т.е. немного больше, чем диаметр хромосомы.
Петли можно увидеть и другим способом. Если из хромосом удалить двухвалентные катионы, на поперечных срезах будут видны петли в форме радиальных рядов нитей размером 10 нм со средней длиной 3-4 мкм. Эти данные согласуются с моделью, в которой петли ДНК длиной около 60 т.п.н. закреплены на центральном белоксодержащем остове.
Негистоновые белки, входящие в состав остова, могут быть металлопротеинами. Хелатирование ионов металлов разрушает остов, но он может быть специфически восстановлен при добавлении ионов Сu2+. Ионы кальция также способствуют образованию остова, хотя, очевидно, менее специфически.
Можно расщепить ДНК, не нарушая целостности остова. Остов выглядит наподобие митотической пары сестринских хроматид. Эти сестринские половины остова обычно тесно соединены, но иногда они разделяются, оставаясь соединенными только немногими нитями. Может ли остов быть той структурой, которая отвечает за форму митотических хромосом? Образуется ли он путем соединения белковых компонентов, которые обычно закрепляют основания петель интерфазного хроматина?
Развитие представлений о нуклеосомах можно проследить начиная с нескольких слабых аргументов, на основе которых была выдвинута первоначальная модель Корнберга (Kornberg, Science, 184, 868-871, 1974) до вполне весомых доказательств, собранных в таких обзорах, как (Kornberg, Ann. Rev. Biochem., 46, 931-954, 1977; McGhee, Felsenfeld, Ann. Rev. Biochem., 49, 1115-1156, 1980; Lewin в Gene Expression, 2, Eucariotic Chromosomes, Wiley, New York, 332-393, 1980).
Взаимоотношения между расщеплением ДНКазой I и периодичностью нуклеосомной ДНК исследовано во всех возможных деталях Клугом и Луттером (Klug, butter, Nuc. Acids Res., 9, 4267-4283, 1981). Вопрос о расположении ДНК на нуклеосоме кратко рассмотрен Вонгом (Wang, Cell, 29, 724-726, 1982). Модель гистонового октамера разработана Клугом и др. (Klug et al., Nature, 287, 509-516, 1980); в этой работе цитируются также ранние работы по структурному анализу. О свойствах нуклеоплазмина сообщили Эрншоу и др. (Earnshaw et al., Cell, 21, 373-383, 1980), которые также рассмотрели вопросы нуклеосомной сборки (Laskey, Earnshaw, Nature, 286, 763-767, 1980).