
Б.ЛЬЮИН
Гены
Перевод с английского
канд.биол.наук А.Л.Гинцбурга,
д-ра биол.наук Т.С.Ильиной,
канд. биол. наук Э. С. Каляевой
и
канд. биол. наук Т. Ю. Переслени
под редакцией
чл.-корр. АН СССР Г.П.Георгиева
Москва «Мир»
1987
Часть Х
ДИНАМИЧНОСТЬ ГЕНОМА:
ПОСТОЯННОЕ ИЗМЕНЕНИЕ ДНК
Элементы, содержащиеся в хромосомах кукурузы ... предназначены для контроля действия генов и индукции в них наследственных модификаций, влияющих на это действие. Эти элементы были открыты благодаря их способности менять свое положение в геноме: исчезать и появляться в новых местах хромосом. Присутствие такого элемента в локусе известного гена или вблизи него влияет на проявление данного гена. Эти элементы получили название контролирующих... Можно думать, что они представляют собой некую внехромосомную субстанцию, способную присоединяться к хромосоме и воздействовать на активность генетического субстрата в этом участке. Однако способы действия контролирующих элементов не подтверждают это предположение. Скорее они свидетельствуют о том, что контролирующие элементы являются компонентами хромосом и обладают таким большим количеством специфических активностей и способов их проявления, каким должны обладать гены... Транспозиции контролирующих элементов либо являются результатом какого-то еще неизвестного механизма, либо происходят во время процесса редупликации хромосомы и представляют собой его следствие.
Барбара Мак-Кпинток, 1958
Глава 36
ТРАНСПОЗИРУЮЩИЕСЯ ЭЛЕМЕНТЫ БАКТЕРИЙ
До недавнего времени было принято считать, что геномы про- и эукариот статичны, что последовательности, образующие их, подвергаются только медленным эволюционным изменениям. Мы привыкли к мысли, что генетическая карта отражает порядок расположения известных генов; подразумевается, что неидентифицированные последовательности также сохраняют постоянное место в геноме. На стабильность генетической организации указывает наличие родственных последовательностей у представителей дивергировавших видов, например у человека и обезьяны. Различие во времени генераций про- и эукариот свидетельствует о том, что они эволюционируют с разной скоростью, но даже у прокариот организация генома меняется относительно медленно. Например, очень сходные генетические карты имеют разные бактериальные виды Е. coli и typhimurium. Эволюция генов происходит как в результате приобретения новых последовательностей, так и в результате перераспределения уже имеющихся. Новые последовательности могут быть введены с помощью векторов или появляться при мутировании существующих генов. Возникновение новых последовательностей возможно также в результате перестроек генетического материала. Такие перестройки могут изменить и функции имеющихся генов путем создания для них новых условий регуляции.
«Традиционная» эволюция генома связана с механизмами, которые хорошо известны в течение многих лет. У прокариот за осуществление генетических обменов ответственны внехромосомные элементы. Плазмиды способствуют конъюгации бактерий, в то время как фаги осуществляют инфекционный процесс. И те и другие иногда переносят вместе с автономным репликоном гены клетки-хозяина. У эукариот в каждой генерации происходит реципрокная рекомбинация между соответствующими сайтами на гомологичных хромосомах; очень редко она сопровождается дупликацией или перестройкой локусов. Такая реорганизация, по существу, представляет собой побочный эффект обычных механизмов, включаемых в генетическую рекомбинацию и (или) синтез ДНК (таких, как неравный кроссинговер или конверсия гена). Механизмы, ответственные за транслокацию между негомологичными хромосомами, остаются неизвестными. Потенциальная возможность для изменения прокарио-тических и эукариотических геномов обеспечивается способностью определенных последовательностей перемещаться из одного сайта в другой. Эти последовательности получили название транспозирующихся элементов, или транспозонов. В ДНК прокариот было найдено множество элементов этого типа. Бактериальные транспозиции включают дупликацию элемента: одна копия сохраняется в исходном донорном сайте, в то время как другая появляется в новом реципиентном сайте, или сайте-мишени. Транспозиция не основана на каком-либо родстве между последовательностями в донорных и реципиентных сайтах, и это отличает ее от всех других механизмов, участвующих в перестройках ДНК. Каждый транспозон несет гены, требуемые для его собственной транспозиции, хотя для этого необходимы также функции генома, в котором находится транспозон (в частности, ДНК-полиме-раза и ДНК-гираза хозяина). О распространенности подобных событий среди эукариот можно судить на основании общего структурного сходства и разнообразия в локализации аналогичных элементов (гл. 37 и 38).
Каковы последствия присутствия в геноме транспозирующихся последовательностей, способных к воспроизведению и перемещению? Возможные преимущества, создаваемые для организма транспозонами, связаны с их способностью индуцировать прямым или косвенным путем перестройки. Событие транспозиции само по себе может вызывать делеции, инверсии или способствовать переносу последовательности хозяина в новое место на хромосоме. Транспозоны могут создавать в клеточных системах частичные области гомологии, поскольку их копии в разных местах (даже на разных хромосомах) обеспечивают возможность реципрокной рекомбинации. Такие обмены могут приводить к делециям, инсерциям, инверсиям или транслокациям.
Транспозирующиеся элементы играют активную роль в эволюции некоторых бактериальных плазмид. Компоненты плазмид могут объединяться друг с другом с помощью реакций, включающих узнавание последовательностей транспозона. Интеграция F-плазмиды (полового фактора) Е. coli в бактериальную хромосому часто осуществляется с помощью RecA-зависимой реципрокной рекомбинации между транспозоном в плазмидной ДНК и гомологичным транспозоном в бактериальной ДНК.
Геномы клетки или фага иногда используют транспозон в собственных целях. В этом случае элемент становится статичным и играет роль в регуляции, участвуя в специфических событиях, подобных транспозиции. Примеры с Salmonella и фагом Mu показывают, что регуляция может включать инверсию специфического сегмента ДНК, осуществляемую посредством рекомбинационного механизма, связанного с транспозицией. Эти процессы проявляют некоторое сходство с интеграцией фага лямбда. Таким образом транспозиционные механизмы принимают участие в целом ряде событий, от соединения негомологичных последовательностей ДНК до обеспечения специфических рекомбинационных процессов.
Следует отметить, что значение транспозонов для природной селекции еще неясно. Существует предположение, что (по крайней мере некоторые) транспозирующиеся элементы не дают ни преимуществ, ни вреда клетке, а представляют собой «эгоистическую ДНК», занятую только своим собственным размножением. Согласно этой концепции, взаимосвязь транспозона с геномом напоминает отношения между паразитом и его хозяином. По-видимому, распространение элементов путем дупликации и транспозиции уравновешивается теми вредными последствиями, которые оказывает внедрение транспозона, приводящее к инактивации необходимого гена. Кроме того, распространение транспозонов может быть ограничено, если их число в клетке становится для нее грузом. Мы должны иметь в виду, что любое транспозиционное событие, обеспечивающее селективные преимущества, например генетические перестройки, обусловливает предпочтительную выживаемость генома, несущего активный транспозон.
Открытие транспозиции у бактерий
Транспозирующиеся элементы были открыты при обнаружении вставок (инсерций) нового материала в пределах бактериальных оперонов. Такие вставки локализуются внутри гена и предотвращают его транскрипцию и (или) трансляцию. Кроме того, они могут проявлять полярный эффект, выражающийся в уменьшении степени экспрессии следующих за ними генов оперона. Первоначально определенные как негативные мутации, вставки были идентифицированы благодаря тому, что в отличие от точечных мутаций единственной формой реверсий для них является делетирование встроенного материала. При сравнении последовательностей, присутствующих в различных инсерционных мутантах, оказалось возможным классифицировать несколько дискретных элементов. Каждый тип элемента мог быть встроен в любой ориентации в определенный сайт.
Поведение многих транспозонов было прослежено в процессе нескольких циклов транспозиции. На рис. 36.1 приведена схема, показывающая состояние как донорной, так и реципиентной молекул. Плазмида, несущая транспозон, введена в клетку, которая содержит другую плаз-миду без транспозона. Производится отбор реци-пиентных молекул, получивших транспозон (например, по инактивации маркера резистентности к антибиотику в реципиентной плазмиде). Затем выделяются молекулы плазмидной ДНК донора и реципиента. Их исследование подтверждает, что реципиентная ДНК действительно приобрела вставку транспозона, а донорная ДНК не утратила его копию. Таким образом, транспозиция связана с образованием дополнительной копии транспозона в реципиентном сайте.
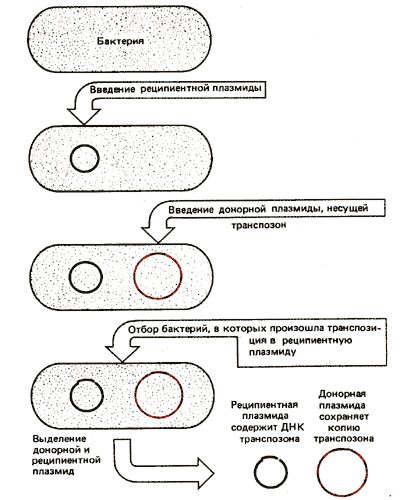
Рис. 36.1. Транспозиция ведет к появлению новой копии транспозона в сайте-мишени, в то время как исходная копия сохраняется в донорном сайте.
Транспозицию часто изучают путем выделения многих независимых вставок в селектируемую область мишени. Дальнейший анализ тонкой структуры показывает, существуют ли какие-либо закономерности в селекции сайтов при внедрении. Большинство транспозонов имеют несколько сайтов внедрения. Некоторые проявляют предпочтительность в отношении «горячих» точек. Транспозоны, у которых в пределах небольшой области сайты внедрений выбираются случайно, могут тем не менее проявлять предпочтительность в отношении одного района по сравнению с другим. Например, в пределах какой-то определенной последовательности длиной приблизительно в 3000 пар оснований внедрения могут быть более частыми, но при этом сайты внутри этой последовательности могут выбираться случайно. Причина такой предпочтительности неизвестна; в таблицах 36.1 и 36.3 она описана как «региональная» специфичность. Наиболее важно, что на молекулярном уровне выбор мишени не зависит от нуклеотидной последовательности (с одним исключением).
Частота транспозиции варьирует для различных элементов в пределах, сравнимых с частотой спонтанных мутаций (от 10^-5 до 10^-7 на поколение). Реверсия (путем делеции) происходит приблизительно в 1000 раз реже, ее частота колеблется от 10^-6 до 10^-10 на поколение.
Существует несколько типов транспозонов, хотя определенные черты являются общими для всех элементов. Каждый из них представляет собой автономную единицу, которая кодирует белки, необходимые для транспозиции. Реакция включает узнавание концов транспозирующегося элемента. Самые короткие транспозоны кодируют только белки, участвующие в транспозиции. (К ним подходит определение «эгоистичной» ДНК.) Более крупные транспозоны несут дополнительные генетические маркеры.
Чем объясняется полярный эффект транспозонов в отношении генов, расположенных дистальнее сайта внедрения транспозона? Внедренная последовательность становится частью полицистронной мРНК оперона. В результате он может препятствовать транскрипции или трансляции. В некоторых случаях проявление полярности объясняется rho-зависимой терминацией транскрипции: в rho-штаммах полярность не наблюдается (гл. 13). В других случаях полярные эффекты возникают в результате терминации трансляции в нонсенс-кодоне транспозона. Так как транспозоны имеют регуляторные сигналы, относящиеся к их собственным генам, эти сигналы иногда могут влиять на события в оперонах. Некоторые транспозоны вблизи их границ содержат промоторы, в которых инициируется транскрипция фланкирующего материала; активируются при этом гены, смежные с элементом.
Первая группа выделенных транспозонов получила название инсерционных последовательностей. Каждый тип инсерционной последовательности обозначается префиксом IS, далее следует номер, соответствующий именно этому типу. (Первые классы получили номера IS 1-4; номера классов, выделенных позднее, отражают историю и не соответствуют общему числу известных в настоящее время элементов.) IS-элементы являются нормальными компонентами бактериальных хромосом и плазмид. Например, один стандартный штамм Е. coli содержит восемь копий IS1 и пять копий IS2. Для обозначения инсер-ции в определенном сайте используется двоеточие; так, обозначение лямбда: IS1 показывает, что IS1-элемент внедрен в геном фага лямбда.
IS-элементы представляют собой простейший класс транспозонов; их генетические функции связаны только со способностью к транспозиции. Несмотря на то что каждый IS-элемент имеет присущую только ему последовательность, форма организации у них общая. Некоторые параметры IS-элементов суммированы в верхней части табл. 36.1.
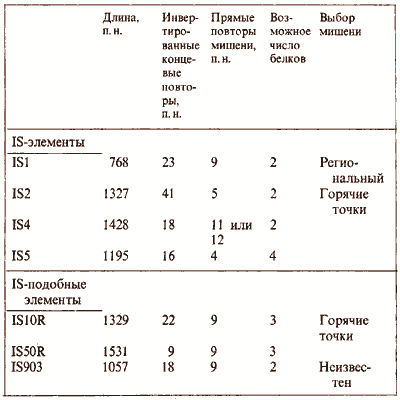
Таблица 36.1
Некоторые транспозоны состоят из отдельных модулей или содержат их в своем составе
Каждый элемент обладает короткими инвертированными концевыми повторами. Обычно их протяженность колеблется от 15 до 25 нуклеотидных пар. Две копии повторов очень близки, но не идентичны. На рис. 36.2 показано, что по направлению к элементу с каждой стороны от него идет одна и та же последовательность.
При транспозиции IS-элемента последовательность ДНК хозяина в сайте внедрения дуплицируется. Природа дупликации установлена при сравнении последовательности сайта-мишени до и после внедрения. ДНК IS-элемента всегда фланкирована очень короткими прямыми повторами. (В этом контексте определение «прямые» означает, что две копии последовательности повторены в одной и той же ориентации, а не то, что они смежные.) Сайт-мишень содержит . последовательность только одного из этих повторов. В случае гипотетической последовательности, изображенной на рис. 36.2, сайт-мишень содержит последовательность:
ATGCA
TACGT
После транспозиции по одной копии этой последовательности представлено с каждой стороны транспозона.
Для большинства транспозонов последовательность прямого повтора в каждом отдельном событии транспозиции отличается, но длина ее остается постоянной (что связано с механизмом транспозиции). Наиболее часто встречаются прямые повторы длиной 5 и 9 пар оснований.
Из рис. 36.2 следует, что транспозон характеризуется определенной структурой; его концы представляют собой инвертированные концевые повторы, а примыкающие концы фланкирующих ДНК хозяина являются короткими прямыми повторами. При анализе последовательности ДНК факт обнаружения такого типа структуры указывает на присутствие транспозона.
Транспозиция всегда связана с внедрением непермути-рованной линейной последовательности. В результате все копии данного транспозона имеют одинаковые инвертированные терминальные повторы в местах соединения с хозяйской ДНК. Важность концевых структур подтверждается терминальной локализацией мутаций, которые предотвращают транспозицию элемента. Эти мутации действуют в цис-положении, следовательно концы узнаются белками, ответственными за транспозицию.
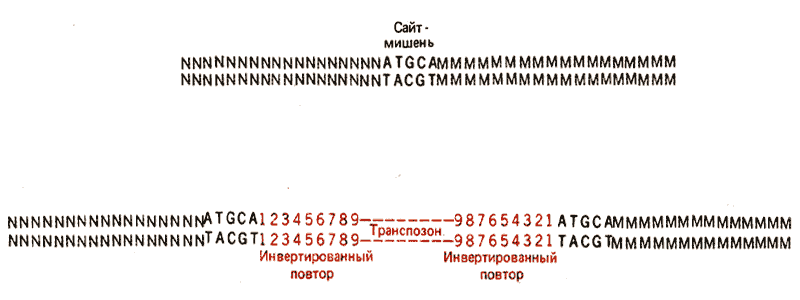
Рис. 36.2. Транспозоны имеют инвертированные концевые повторы. Внедрение транспозонов вызывает образование в сайте-мишени прямых повторов фланкирующей ДНК.
В этом примере сайт-мишень представлен последовательностью из 5 п. н. Концы транспозона содержат инвертированные повторы из 9 п.н. Цифры 1-9 указывают последовательность пар оснований.
Самый короткий по длине транспозон, IS1, содержит две открытые рамки считывания в одном и том же направлении; они транслируются в белки InsA и InsB (их функции еще не установлены). Все другие IS-элементы содержат одну длинную кодирующую область, начинающуюся внутри инвертированного повтора в одном конце и заканчивающуюся перед инвертированным повтором (или внутри его) в другом конце. Такая длинная рамка считывания фактически транслируется всегда; в некоторых случаях продукт считывания был выделен. Обычно существуют некоторые потенциально кодирующие области на другой цепи ДНК (т.е. та же последовательность считывается в противоположном направлении). Используются ли такие перекрывающиеся рамки считывания для синтеза белков, не известно, но они включены в табл. 36.1 при подсчете возможных продуктов.
Сложные транспозоны содержат IS-модули
Некоторые транспозоны (помимо генов, связанных с транспозицией) несут маркеры лекарственной устойчивости (или какие-либо другие). Такие транспозоны обозначаются как Тn с добавлением соответствующего номера. Один класс более крупных транспозонов представлен сложными элементами, состоящими из центральной области, несущей маркер лекарственной устойчивости, и фланкирующих с каждой стороны родственных последовательностей (плеч). Их иногда называют длинными концевыми повторами (LTR). (Не следует путать с короткими инвертированными концевыми повторами у IS-элементов.) Плечи могут либо иметь одну и ту же или (более часто) инвертированную ориентацию. Таким образом, сложный транспозон с плечами, представленными прямыми повторами, имеет структуру: Если плечи представлены инвертированными повторами, транспозон имеет структуру:


Стрелки указывают ориентацию плеч, которые идентифицированы как L и R в соответствии с ориентацией генетической карты транспозона слева направо. Детали структуры сложного транспозона представлены на рис. 36.3. Иногда плечи состоят из идентичных IS-эле-ментов. В случае Tn9 на каждом конце транспозона присутствует прямой повтор IS1-элемента.
В других случаях плечи напоминают IS-элементы. Каждое включает одну непрерывную открытую рамку считывания, фланкированную короткими инвертированными концевыми повторами. Однако, поскольку такие элементы в виде отдельных компонентов в составе бактериальной ДНК не найдены, они получили название IS-пoдобных элементов. IS-подобные элементы так же, как и IS-элементы, обычно получают номер того транспозона, в котором они обнаружены. Их свойства сравниваются со свойствами IS-элементов в нижней части табл. 36.1.
Особенности некоторых сложных транспозонов суммированы в табл. 36.2. Поскольку плечи представляют собой часть сложного транспозона и в то же время напоминают IS-элемент или даже ими являются, иногда их описывают как IS или IS-подобные модули. В некоторых случаях модули сложных транспозонов идентичны, например у Tn9 (прямые повторы IS1) или у Tn903 (инвертированные повторы IS903). В других случаях модули очень близки, но не идентичны. Мы можем отличить модули IS10L и IS10R. (В этом случае L и R терминологически идентифицируют различные модули; если же модули идентичны, та же терминология указывает на их положение относительно центральной области транспозона.)
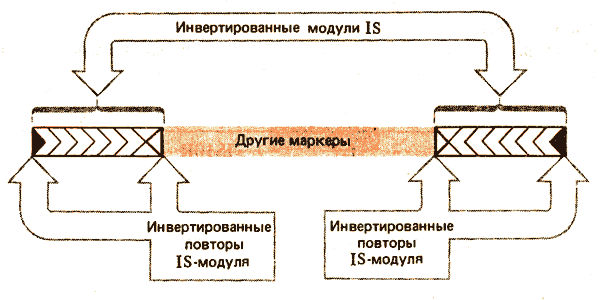
Рис. 36.3. Сложные транспозоны имеют центральную область, несущую маркеры, не связанные с транспозицией (например, ген лекарственной устойчивости). Центральная область фланкирована IS-модулями. Модули имеют короткие инвертированные концевые повторы. Если модули находятся в инвертированной ориентации относительно друг друга (как показано на рисунке), короткие инвертированные повторы на концах транспозона являются идентичными.
Все модули имеют концевые инвертированные повторы, поэтому сложный транспозон также заканчивается короткими инвертированными повторами. (Если плечи имеют инвертированную ориентацию относительно друг друга, короткие инвертированные повторы на концах транспозона, вероятно, идентичны, а не родственны.)
Несмотря на то что IS-подобные модули обычно не существуют в виде независимых элементов в бактериальной ДНК (отсюда и происходит их название), функциональный модуль может транспозироваться, как это показано в случае IS10R транспозона Тn10 или IS50R Тn5. Если модули сложных транспозонов идентичны, по-видимому, любой из них может обеспечивать перемещение. Если же модули различны, транспозиция, вероятнее всего, будет зависеть от одного из них.
Мы предполагаем, что сложные транспозоны образуются путем объединения двух первоначально независимых модулей с центральной областью. Такая ситуация может возникнуть в случае, когда IS-элемент транспози-руется в реципиентный сайт, находящийся вблизи донорного сайта. Будучи исходно идентичными, эти модули могут сохранять свою идентичность или дивергировать. Способность одного модуля обеспечивать транспозицию всего сложного элемента можно объяснить отсутствием селективного давления в отношении сохранения активностей обоих модулей.
Представляет интерес вопрос о том, как кооперируются два модуля при транспозиции сложного транспозона в тех случаях, когда функционально активны они оба. Например, у Тn9, по-видимому, каждый модуль (IS-элемент) активен как в отношении своей собственной транспозиции, так и в отношении сложного транспозона. Если один из модулей транспозируется независимо, существованию сложного транспозона это не грозит, поскольку транспозиция ведет к появлению новой копии в сайте-мишени (хотя такое событие и не служит цели дальнейшего распространения всего транспозона).

Таблица 36.2
Некоторые сложные транспозоны фланкированы отдельными модулями
В действительности два IS-элемента способны транс-позировать любую последовательность, заключенную между ними, а также свои собственные последовательности. Схема эксперимента, который демонстрирует такую способность, представлена на рис. 36.4. Если Тn10 находится в составе кольцевого репликона, два его модуля могут рассматриваться фланкирующими либо ген tet^r исходного транспозона, либо последовательность в другой части кольца. В результате в событие транспозиции могут вовлекаться исходный транспозон Тn10 или транспозон «наизнанку» с противолежащей центральной областью. Оба они имеют инвертированные модули, но эти модули, очевидно, способны функционировать в любой ориентации относительно центральной области. В таких случаях частота транспозиции тем меньше, чем больше расстояние между модулями. Зависимость от длины, вероятно, свидетельствует о проблемах, которые возникают во время транспозиции. Используя эту зависимость, можно определять размеры сложных транспозонов.
Суммируя свойства, определяющие способность к транспозиции IS- или IS-подобных элементов, следует отметить, что все они, кроме IS1, кодируют один главный продукт гена, соответствующий рамке считывания, простирающейся на длину элемента. Этот единственный продукт, вероятно, ответствен за нахождение сайта-мишени и узнавание концов транспозона. Для транспозона, используемого в качестве субстрата при транспозиции, необходимы только концы. Функции хозяина могут быть нужны для репликации транспозона. О деталях процессов и порядке событий, включаемых в эти реакции, нам известно немного, однако можно предположить их сходство для всех IS-элементов и сложных транспозонов (пожалуй, за исключением IS1).
Только один модуль транспозона Тn10 функциональный
Об эволюции сложного транспозона можно судить при сравнении модулей уже не идентичных, но еще сохраняющих родство. В этом отношении больше всего известно о транспозонах Тn10 и Тn5.
Для узнавания элемента в качестве субстрата транспозиции необходимы несколько оснований в каждом конце транспозона Tn10. Инвертированные концевые повторы имеют длину, равную 22 парам оснований; из них, вероятно, только последние 13 важны для реакции транспозиции. Мутации в этой области предотвращают транспозицию и являются цис-активными.
Тn10-необычный элемент, имеющий специфическую последовательность в сайте-мишени. Прямые фланкирующие повторы из 9 пар оснований, которые образуются при транспозиции, обнаруживают обобщенную последовательность из 6 нуклеотидных пар, симметрично расположенную в сайте-мишени. Так, повторы с каждой стороны Тn10 часто представлены последовательностями
NGCTNAGCN
NCGANTCGN
где N соответствует любой паре оснований. Чем «сильнее выражена» горячая точка, тем больше она соответствует канонической последовательности. Не исключено, что одна и та же Tn10-кодируемая функция узнает последовательность мишени и концы транспозона. Активным модулем Тn10 служит элемент IS10R. Модуль IS10L функционально дефектен и обеспечивает только 1-10% транспозиционной активности IS10R. Накопление мутаций в IS10L по сравнению с IS10R и обусловливает их примерно 2,5%-ную дивергенцию.
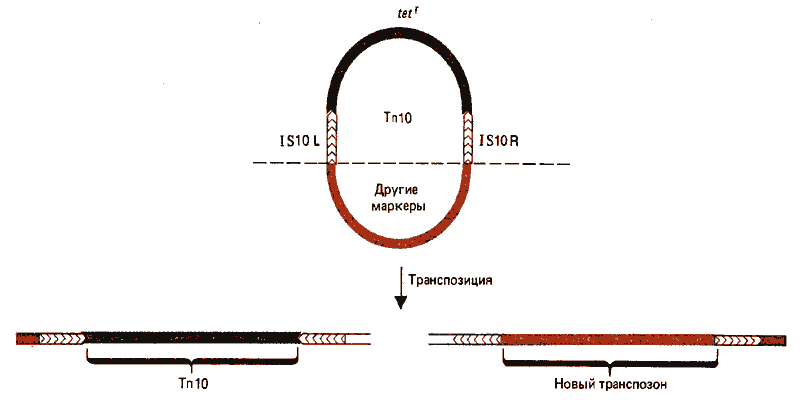
Рис. 36.4. Модули IS10 способны кооперироваться и транспозировать любую область ДНК, которая лежит между ними. Если Тn10 входит в состав кольцевой молекулы, повторы IS10 могут обеспечить транспозицию любой стороны кольца. Транспозиция tef соответствует перемещению Tn10. Транспозиция маркеров, находящихся на другой стороне, создает новый «вывернутый» транспозон.
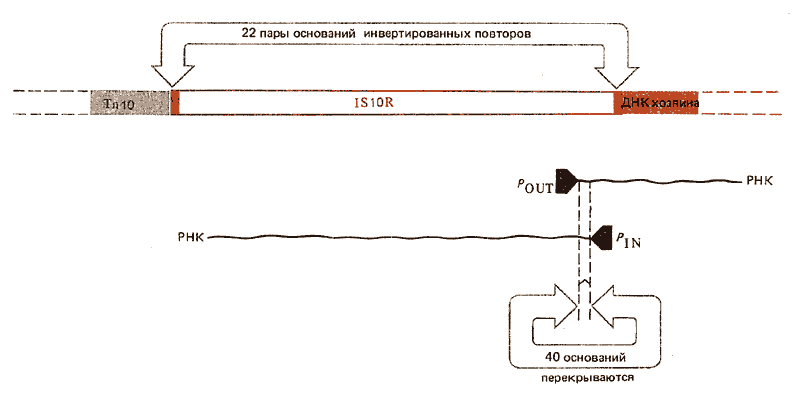
Рис. 36.5. Два промотора в противоположной ориентации расположены вблизи наружной границы IS10R. Сильный промотор P OUT обеспечивает транскрипцию фланкирующей ДНК хозяина. Более слабый промотор P IN начинает транскрипцию РНК с кодирующей области, которая распространяется на всю длину IS10R. Транскрипция типа OUT и IN перекрывается в области, протяженность которой равна 40 парам оснований.
На рис. 36.5 показана организация IS10R. Он имеет непрерывную рамку считывания, которая кодирует существенный белок с мол. массой 47000 дальтон; значение другой перекрывающейся рамки считывания неизвестно. Уровень продукции существенного белка повышается благодаря мутациям, увеличивающим степень выражения гена IS10R. Следовательно, количество этого белка может ограничивать скорость транспозиции.
Мутации в этом гене могут быть комплементированы в транс-положении другим элементом дикого типа, однако эффективность комплементации выражена слабо. Это свидетельствует о предпочтительном цис-действии белка. По непонятной причине белок эффективно функционирует только на той ДНК-матрице, с которой он был транскрибирован и транслирован. Это общее свойство белков, участвующих в IS-опосредованной транспозиции. (Мы уже говорили о цис-предпочтительности белка А, участвующего в репликации фХ174, гл. 33.)
При увеличении расстояния между геном транспозазы и концами транспозона IS10 эффективность действия транспозазы падает. Причина этого явления, по-видимому, заключается в предпочтительном узнавании транспозазой последовательностей ДНК мишени, расположенных вблизи того сайта, в котором она синтезируется. Можно предположить, что транспозаза настолько быстро связывается с ДНК после (или во время) белкового синтеза, что не успевает диффундировать. Реальна и другая ситуация: транспозаза может отличаться такой нестабильностью, что белковые молекулы, неспособные быстро связываться, никогда не смогут стать активными.
Вблизи внешней границы IS10R обнаружено два промотора. Один из них PIN ответствен за транскрипцию IS10R, другой-Роит вызывает транскрипцию, протекающую в смежной фланкирующей ДНК. Возможно, этот эффект связан с активацией бактериальных генов, сце3 пленных с Тn10.
Мультикопийное ингибирование свидетельствует о регуляции экспрессии гена IS10R. Транспозиция Тn10-эле-мента на бактериальной хромосоме уменьшается, если в составе мультикопийной плазмиды ввести в клетки дополнительные копии IS10R. Ингибирование требует присутствия последовательности промотора P OUT и эффективно только в отношении гена IS10R, экспрессируемого при участии P IN-промотора (если ген находится под контролем другого промотора, эффект увеличивается). Однако мультикопийное ингибирование действует на уровне трансляции, а не транскрипции. Этот эффект может объясняться наличием перекрывания на участке в 40 пар оснований 5'-концевых областей транскриптов, инициируемых в P IN и P OUT- Так как P OUT является более сильным промотором, может образовываться большое количество OUT-PHK, и эта РНК может в свою очередь спариваться с IN-PHK, предотвращая трансляцию белка, необходимого для транспозиции.
Модули транспозона Тn5 почти идентичны, однако функционально очень различаются
Инвертированные модули Тn5 служат удивительным примером того, как небольшие мутационные изменения вызывают важные функциональные эффекты. Модуль IS50R функциональный; модуль IS50L нефункциональный в отношении транспозиции. Единственное различие между ними обусловлено заменой одной пары оснований. Результаты этой замены демонстрируются на рис. 36.6.
В модуле IS50R при использовании одной и той же рамки считывания образуются два белка. Единственное различие между ними состоит в наличии у белка 1 примерно 40 дополнительных N-концевых аминокислот, отсутствующих у белка 2. Точные события, включаемые в транскрипцию и трансляцию этих белков, еще не установлены; известно только, что белок 2 образуется в больших количествах, чем белок 1.
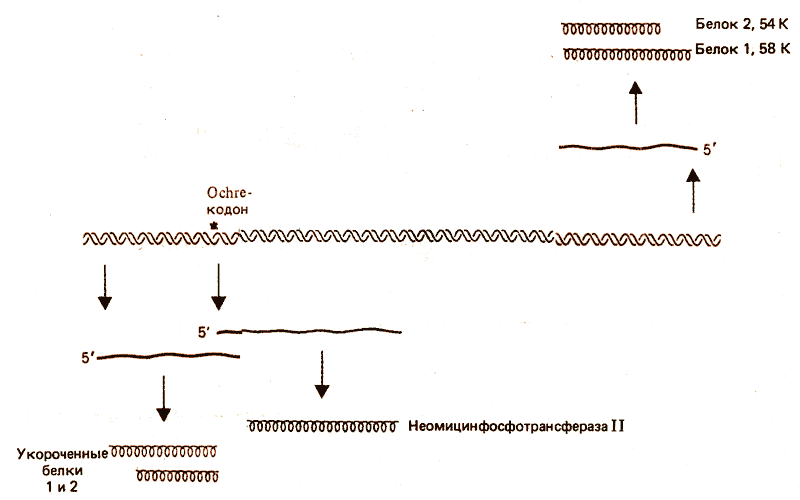
Рис. 36.6. Замена одной пары оснований в IS50L преждевременно терминирует синтез белков 1 и 2 и создает промотор для транскрипции гена неомицин- и канамицин-резистентности.
Замена одной пары оснований в IS50L одновременно влияет на трансляцию этих белков и контролирует транскрипцию центральной области. Замещение ведет к образованию ochre-кодона, который преждевременно терминирует трансляцию как белка 1, так и белка 2. Урезанные белки (иногда называемые белками 3 и 4) утрачивают транспозиционную активность. То, же самое замещение создает промотор для транскрипции гена центральной области, который кодирует неомицинфосфотрансферазу II, фермент, .ответственный за устойчивость к таким антибиотикам, как неомицин и канамицин. Следовательно, для проявления этой функции транспозона такая замена необходима.
Функции белков 1 и 2 родственны, но различны. Белок 1 существен для. транспозиции любого модуля IS50 или интактного транспозона Tn5. Белок дикого типа компле-ментирует дефектный модуль в транс--положении крайне неэффективно. Следовательно, белок 1 может быть цис-активной функцией транспозиции.
Белок 2 служит ингибитором транспозиции. Его действие осуществляется на какой-то еще неизвестной стадии самого процесса транспозиции (а не путем регуляции экспрессии гена). Белок 2 функционирует в транс-положении; механизм его действия может заключаться в связывании с теми же сайтами, которые должны узнаваться белком 1 для осуществления его транспозиционной функции. Таким образом, эта функция будет подавлена. Другая возможность -образование белками 1 и 2 олигомер-ного комплекса, в котором активность белка 1 также окажется подавленной.
Поведение белка 2 может объяснить свойство транспозона Тn5. При введении в клетки нового бактериального хозяина Тп5, транспозируется с высокой частотой.
Внедренный элемент способен также подавлять транспозицию вводящего элемента. Такая транс-действующая функция может отражать способность белка 2 препятствовать транспозиции; при вхождении нового элемента в клетку в ней уже присутствует такое количество белка 2, которое достаточно, чтобы ингибировать цис-действующую функцию белка 1 как нового, так и старого Тn5-элемента. Вполне возможно, что укороченные белки IS50L тоже вовлечены в, этот эффект.
Взаимосвязь между белками 2 и 1 транспозона Тn5 отличается по природе от взаимосвязи между :транскриптами P OUT и P IN транспозона Tn10. Однако их объединяет общее свойство: они ограничивают частоту транспозиции. Механизмы, которые ограничивают транспозоны в размножении, могут играть важную роль в предотвращении слишком сильного вмешательства транспозонов в клеточные функции.
Транспозиция включает репликативную рекомбинацию
Термин «транспозиция» является, по существу, неправильным, поскольку транспозон не покидает своего исходного сайта. Процесс транспозиции включает дупликацию транспозона; при этом одна копия сохраняется в исходном сайте, а другая обнаруживается в новом. Следовательно, транспозиция сопровождается увеличением числа копий транспозона.
Природа транспозиционного события, по-видимому, одинакова для всех транспозонов; об этом свидетельствует наличие повторов коротких последовательностей ДНК мишени. Транспозиция включает два типа реакций, которые в принципе могут происходить в любом порядке. Одна из них связана с репликацией транспозона без репликации прилегающих хромосомных последовательностей. Другая требует разрыва последовательности ДНК мишени, приводящего к образованию сайта, в который и внедряется транспозон. Ни на одной из стадий в этом процессе ДНК транспозона не существует в виде свободной молекулы; все события транспозиции происходят на ДНК, в пределах которой находится транспозон.
Основные этапы реакции внедрения показаны на рис. 36.7. Они включают образование ступенчатого разреза в ДНК мишени, соединение транспозона с образующимися одноцепочечными концами и заполнение брешей. Образование и дрстройка ступенчатых концов делают понятным наличие прямых повторов ДНК мишени в сайте внедрения. Расстояние между разрезами на двух цепях определяет длину прямых повторов; следовательно, повтор последовательности мишени, характеризующий каждый транспозон, отражает способ действия фермента, вовлекаемого в процесс разрезания ДНК мишени.
Общий конечный результат транспозиции маскирует наличие более чем одного механизма дупликации транспозона и его внедрения. Существование по крайней мере двух основных типов транспозиции показано как различиями в самих транспозиционных событиях, так и различиями между продуктами реакции.
Наряду с «простой» межмолекулярной транспозицией, которая ведет к внедрению дополнительной копии в новый сайт, транспозоны способствуют другим типам перестроек в ДНК. Некоторые из этих событий могут представлять альтернативные результаты работы транспозиционного механизма; они дают ключ к решению вопроса о природе этого механизма. Другие события являются следствием взаимоотношений между множеством копий транспозона.
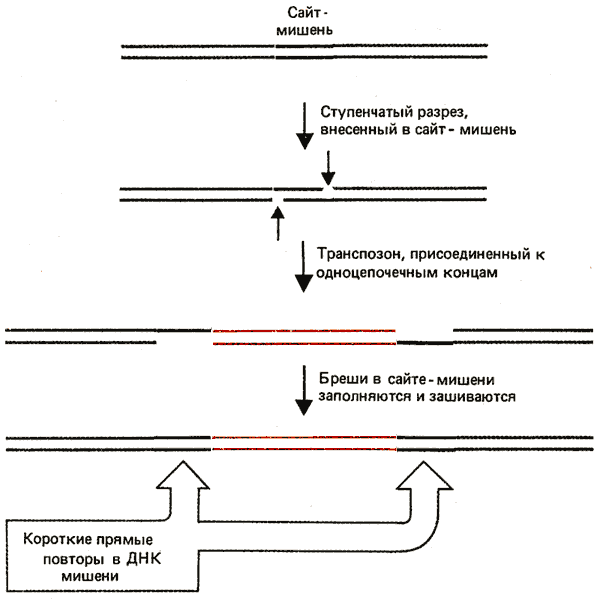
Рис. 36.7. Прямые повторы ДНК мишени, фланкирующей транспозон, формируются в результате введения ступенчатых разрезов; образующиеся выступающие концы соединяются с транспозоном.
Перестройки в хозяйской ДНК могут возникать в тех случаях, когда вторая копия транспозона внедряется в другой сайт вблизи исходного. Системы клетки-хозяина могут осуществить реципрокную рекомбинацию между копиями транспозона; последствия этих событий зависят от того, находятся повторы в прямой или инвертированной ориентации.
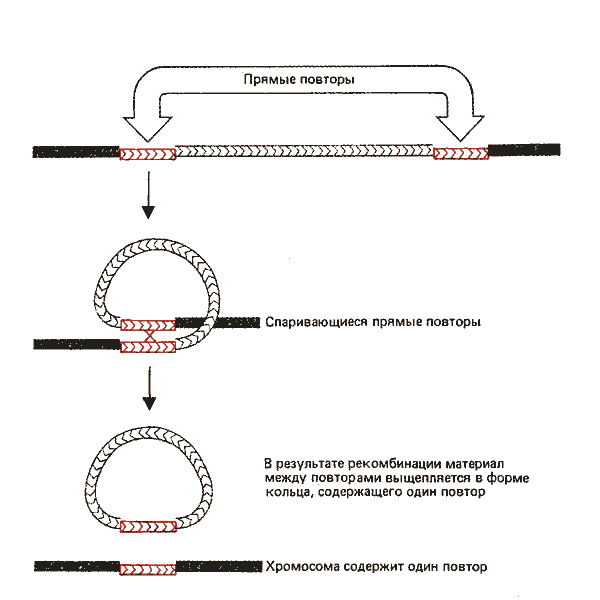
Рис. 36.8. Реципрокная рекомбинация между прямыми повторами ведет к вырезанию материала, находящегося между ними; каждый продукт рекомбинации содержит одну копию прямого повтора.
На рис. 36.8 показано, что рекомбинация между любой парой прямых повторов будет приводить к делетированию материала между ними. Промежуточная область вырезается в виде кольцевой ДНК (которая утрачивается клеткой); хромосома сохраняет одну копию прямого повтора. Следует отметить, что рекомбинация между прямо повторенными модулями ISI сложного транспозона Тn9 будет поэтому заменять транспозон на один модуль IS1. Делегирование последовательности, прилегающей к транспозону, может происходить в результате двухступенчатого процесса; сначала в результате транспозиции возникает прямой повтор последовательности транспозона, а затем между повторами происходит рекомбинация. Однако большинство делеций, которые возникают вблизи транспозонов, являются результатом вариации в процессе транспозиции.
На рис. 36.9 изображены последствия реципрокной рекомбинации между парой инвертированных повторов. Область между повторами становится инвертированной; сами повторы сохраняют способность стимулировать дальнейшие инверсии. Двойные инверсии связаны с транспозицией и принимают форму транспозонов, находящихся в инвертированной ориентации с каждой стороны от центральной области, которая тоже была инвертирована по отношению к ее обычной ориентации. Заметим, что сложный транспозон, чьи модули инвертированы, представляет собой стабильный компонент генома, хотя направление центральной области по отношению к модулям может быть инвертировано в результате рекомбинации.
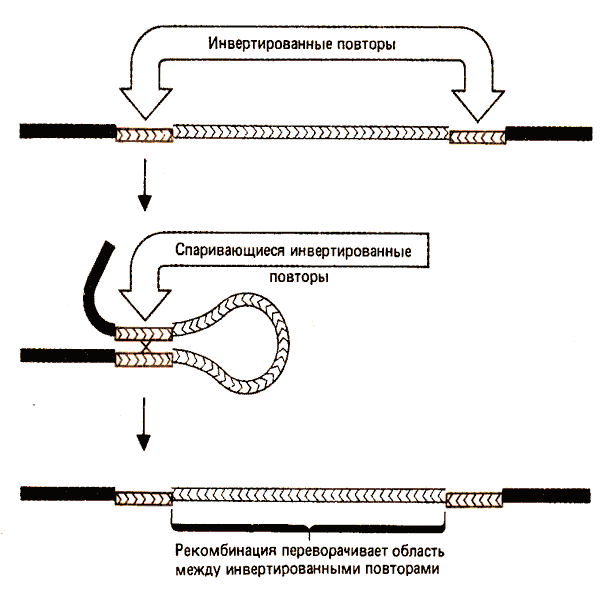
Рис. 36.9. Реципрокная рекомбинация между инвертированными повторами переворачивает область между ними.
В списке событий, происходящих с транспозоном важное место занимает процесс его исключения. Утрату транспозона можно определить по восстановлению функции в сайте внедрения. Такое восстановление происходит только при точном исключении; частота этого события примерно 10^-6 для транспозона Тn5. Кроме того, потеря транспозона может быть определена по снятию полярного эффекта в смежных генах; это бывает и в результате неточного исключения (которое оставляет часть транспозона, достаточную для предотвращения реактивации гена, служащего мишенью, но недостаточную для того, чтобы обусловливать полярный эффект). Неточное исключение встречается с частотой примерно 10^-5 для Тn5. Ни один тип исключения не связан с транспозицией в новые сайты. Процесс не зависит от функций, кодируемых транспозоном; он является RecA-независимым и может осуществляться с помощью какого-то клеточного механизма, порождающего спонтанные делеции между близко расположенными повторяющимися последовательностями.
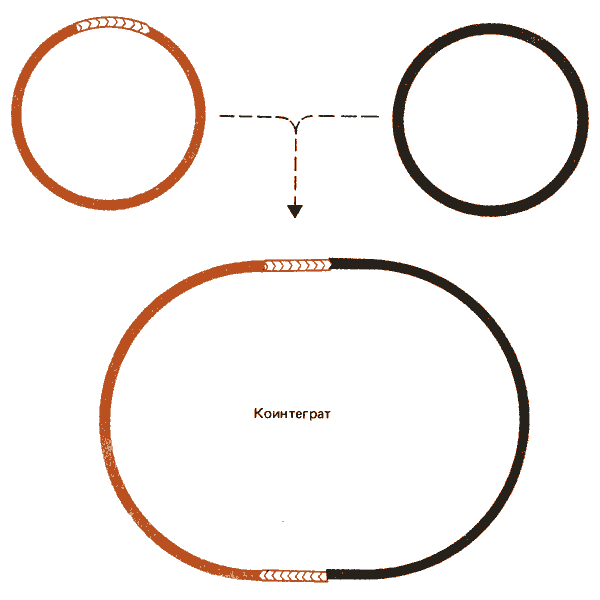
Рис. 36.10. Транспозиция может вести к слиянию донорного и реципиентного репликонов с образованием коинтеграта.
Частоты, с которыми различные транспозоны образуют коинтеграты, свидетельствуют о существовании различных путей транспозиции. Например, Tn903 и ISI могут примерно с равной частотой осуществлять транспозицию и формировать коинтеграты. Однако у Tn5 и Tn10 транспозиция происходит примерно в 50-200 раз чаще, чем образование коинтегрированных структур. Коинтеграты, образуемые при участии Тn5, отличаются стабильностью. Это позволяет предположить, что их образование - результат транспозиции, а не промежуточный продукт этого процесса.
Модель транспозиции, по которой коинтеграт представляет собой обязательный промежуточный продукт, иллюстрирована на рис. 36.11. Четыре одноцепочечных разреза инициируют процесс. Донорная молекула разрезается в каждом конце транспозона с помощью сайтспе-цифического фермента, который узнает его конец. Молекула мишени разрезается в сайтах, расположенных ступенчато, обычно на расстоянии 5 или 9 оснований друг от друга. Порядок и время, в которое производится разрез во время транспозиции, могут быть изменены. Разрезы в цепях донора и мишени сшиваются. Каждый конец последовательности транспозона присоединяется к одному из одноцепочечных концов, образовавшихся в сайте мишени. В результате образуется chi-образная структура, удерживаемая двухцепочечной ДНК транспозона. Образование такой структуры приводит к перемещению транспозона; ферментативная активность, ответственная за такое перемещение, получила название тран позазы.
Chi-образная структура содержит одноцепочечную область в каждом из ступенчато разрезанных концов. Эти области используются в качестве псевдорепликационных вилок, обеспечивающих матрицу для синтеза ДНК. (Использование концов в качестве затравок для репликации означает, что должен иметь место разрыв цепи с полярностью, в результате чего в этой точке образуется 3'-конец.) Если репликация продолжается от обеих репликационных вилок, она идет через транспозон, разделяет его цепи и терминируется в его концах. Репликация выполняется, по-видимому, с помощью ферментов, кодируемых клеткой-хозяином. По окончании репликации структура становится коинтегратом, обладающим прямыми повторами транспозона в местах соединения между репликонами (в чем можно убедиться при анализе последовательности, составляющей коинтеграт).
Сайтспецифическая рекомбинация между двумя копиями транспозона может восстановить исходный донорный репликон, освободив при этом репликон мишени, который приобрел транспозон. Такое событие получило название разрешения; фермент, ответственный за эту активность, называется резолвазой.
Транспозиция TnЗ происходит путем разрешения коинтеграта
Существуют большие ( ~ 5 т. п. н.) элементы, транспозиция которых не зависит от модулей IS-типа. Они представляют собой независимые единицы, несущие как гены, кодирующие функции транспозиции, так и гены, кодирующие резистентность к антибиотику. К наиболее изученным транспозонам такого типа относятся представители семейства ТnА. Первоначально полагали, что оно включает только один транспозон, однако их обнаружено много (табл. 36.3).
Транспозиция этих элементов осуществляется в две ступени: сначала образуются коинтеграты, а затем эти коинтеграты разрешаются. Каждая стадия проходит при участии различных продуктов, кодируемых транспозоном (в отличие от единственного белка транспозиции IS-элемента). Так же как у элементов типа IS, в этом случае в стадии транспозиции участвуют концы элемента. Уникальным свойством транспозонов TnA-семейства является то, что их стадия разрешения требует специфического внутреннего сайта.
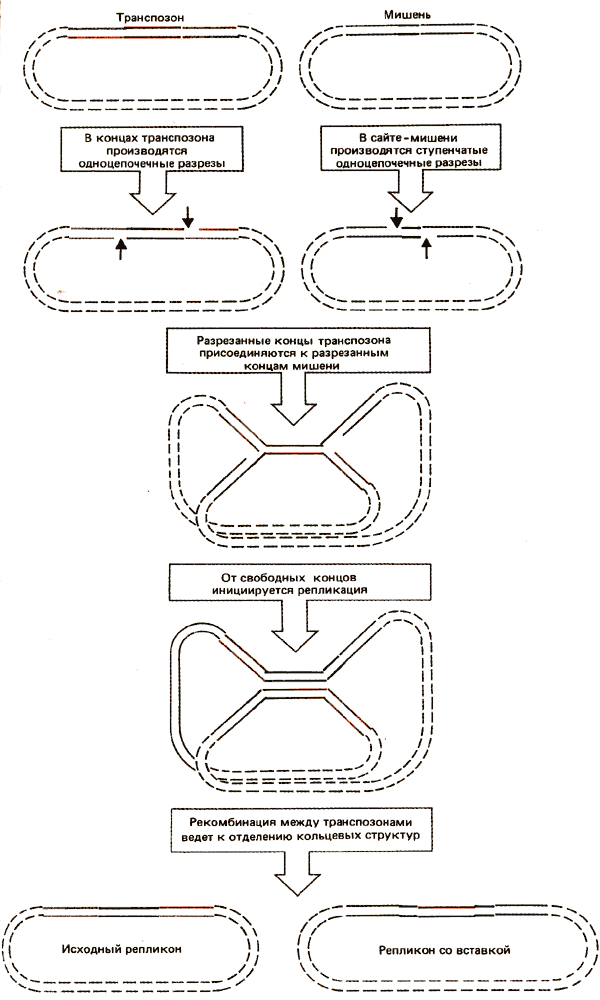
Рис. 36.11. Один из путей транспозиции ведет к образованию коинтегратов, которые разрешаются рекомбинацией.

Таблица 36.3
Семейство транспозонов TnА представлено большими, но тем не менее индивидуальными единицами
Транспозоны ТnА обычно на концах имеют близкородственные инвертированные повторы длиной около 38 пар оснований. Цис-активные делении в любом из них предотвращают транспозицию элемента. В сайте-мишени образуются прямые повторы из 5 пар оснований, выбираемых случайно, хотя и с региональной предпочтительностью.
С помощью рецессивных мутаций идентифицированы два гена, продукты которых необходимы для транспозиции. Так как мутантные гены могут быть комплементированы в транс-положении генами дикого типа другой копии транспозона, их действие не проявляет цис-активной предпочтительности, характерной для транспозиционного процесса IS-типа.
Мутанты по гену tnpA не способны осуществлять транспозицию. Продукт этого гена - транспозаза - состоит из 1021 аминокислоты (примерно 120 000 дальтон). Очищенный белок способен связываться с одноцепочечной ДНК. О его функции известно немного, хотя показано, что он необходим для узнавания концов элемента и для осуществления ступенчатого разреза с промежутком между разрезами на отдельных цепях в 5 пар оснований. В месте ступенчатого разреза происходит соединение концов транспозона с ДНК мишени. Транспозазы TnЗ и родственного элемента уб эффективно работают только на свой собственный тип транспозона, хотя концы элементов одинаковы на участке в 27 из 38 пар оснований инвертированных повторов. Возможно, что некоторые из отличающихся позиций представляют собой критические точки при узнавании концов.
Мутации в гене tnpR увеличивают частоту транспозиции. Причина такого эффекта заключается в том, что TnpR репрессирует транскрипцию как tnpA, так и своего собственного гена. В результате инактивация белка TnpR ведет к увеличению синтеза белка TnpA, что в свою очередь обусловливает возрастание частоты транспозиции. Следовательно, количество транспозазы TnpA служит ограничивающим фактором в транспозиции.
Гены tnpA и tnpR транскрибируются дивергентно от А-Т-богатой межцистронной контролирующей области длиной в 163 пары оснований, как показано на карте транспозона Тn3, представленной на рис. 36.12. (Другие транспозоны TnA-типа имеют такую же организацию.) Оба эффекта белка TnpR проявляются при его связывании в этой области.
Белок TnpR, функционируя в качестве резолвазы, вовлекается в рекомбинацию между прямыми повторами Тn3 в структуре коинтеграта. Коинтеграт представляет собой обязательный промежуточный продукт при транспозиции; разрешение коинтегратов блокируется в мутантах tnpR-, что ведет к образованию только коинтегрированных структур.
В принципе коинтеграты могут быть разрешены с помощью гомологичной рекомбинации между любой соответствующей парой точек в двух копиях транспозона (рис. 36.11). Однако на деле реакция разрешения происходит только в специфическом сайте. Этот сайт первоначально был идентифицирован цис-действующими делециями во внутренней области, которые блокируют завершение транспозиции, вызывая накопление коинтегратов. Сначала сайт был обозначен как IRS (от англ. internal resolution sequence); теперь он известен как res-сайт. В отсутствие res реакция разрешения может быть замещена RecA-зависимой общей рекомбинацией, но она происходит со значительно меньшей эффективностью.
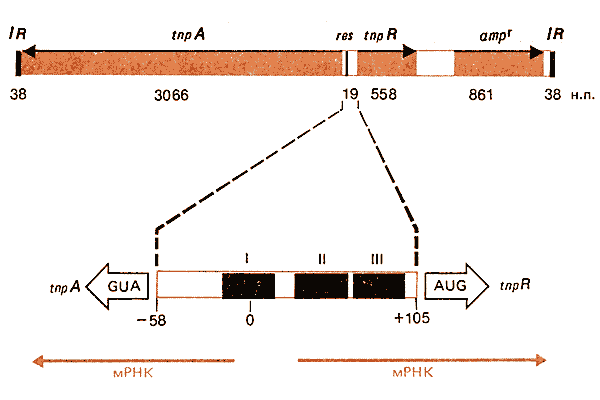
Рис. 36.12. Транспозоны, подобные Тn3, имеют инвертированные концевые повторы, внутренний сайт res и три известных гена. Стрелками указывается направление выражения кодирующих областей. Цифры в верхней части диаграммы указывают длину каждой области. Цифры в нижней части диаграммы показывают расстояния от точки перекреста (0).
Сайты связывания резолвазы TnpR удалось определить с помощью метода отпечатков комплекса ДНК—белок. Данные об их локализации суммированы в нижней части рис. 36.12. Связывание происходит независимо в каждом из трех сайтов длиной в 30-40 пар оснований. Сайт I включает область, генетически идентифицированную как res-сайт; в его отсутствие реакция разрешения не происходит вообще. Однако разрешение включает также связывание в сайтах II и III, поскольку при делеции любого из них реакция разрешения идет с низкой эффективностью. По-видимому, сайт I перекрывается со стартовой точкой транскрипции tnpA. Сайт II перекрывается со стартовой точкой транскрипции tnpR; мутация оператора картируется в самом левом конце сайта.
Три сайта связывания в Тn3 несут гомологичную последовательность, которая определяет каноническую (усредненную) последовательность; имеется двойная симметрия в сайтах. Как они взаимодействуют между собой? Одна из возможностей сводится к тому, что связывание во всех трех сайтах необходимо для удержания определенной топологической конформации в ДНК; реакция разрешения может начаться, когда комплекс ДНК—белок одного транспозона будет взаимодействовать с таким же комплексом другого транспозона. Связывание только в одном наборе сайтов может репрессировать транскрипцию генов tnpA и tnpR, не вызывая каких-либо изменений в ДНК.
Область, в которой происходит сайтспецифическая рекомбинация, впервые была идентифицирована при сравнении реакций транспозонов TnЗ и gd, у которых гены tnpRпроявляют высокую гомологию и могут замещать друг друга в комплементационных исследованиях. Последовательности рекомбинантов свидетельствуют о том, что реакция разрешения происходит в пределах 19 пар оснований сайта I, идентичных в обоих транспозонах.
Значительно больше информации о реакции разрешения было получено в опытах по разрешению коинтегратов in vitro. В качестве субстрата в этих экспериментах использовали коинтеграт-подобную молекулу ДНК. (Субстрат был сконструирован путем клонирования с образованием прямых повторов в двух областях плазмиды pBR322.) Субстрат должен иметь суперспиральную структуру; его разрешение ведет к образованию сцепленных колец, каждое из которых содержит один res-сайт. Реакция требует присутствия больших количеств резолвазы TnpR (которую получают в нужном количестве благодаря применению стандартных методов клонирования). Разрешение происходит наиболее эффективно при соотношении фермент/ДНК, равном примерно 20/1. Факторы хозяина в этой реакции не требуются (в противоположность сайтспецифической рекомбинации фага лямбда).
Разрешение - консервативный процесс; связи при этом разрываются и восстанавливаются без поглощения энергии. Для завершения реакций необходимы ионы магния; если они отсутствуют, происходит лишь частичная реакция с низкой эффективностью. В результате такой реакции получаются продукты, соответствующие промежуточной стадии в разрешении коинтегратов; они состоят из резолвазы, ковалентно связанной с обоими концами, образовавшимися при двухцепочечном разрезе, произведенном в res-сайте. Разрезание производится симметрично в коротких палиндромных областях; в результате образуются выступы из двух оснований. Развивая представление об области перекреста, расположенной в сайте I, мы можем описать реакцию разрезания следующим образом:
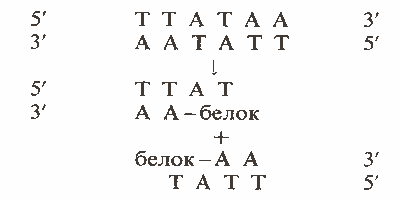
На основании родства сайта resс кором att-сайта фага лямбда (гл. 35) можно предположить наличие сходства между этой системой и сайтспецифической рекомбинацией фага лямбда. Между двумя сайтами существует гомология в 10 из 15 пар оснований, непосредственно окружающих точку перекреста. Ниже представлены эти последовательности:
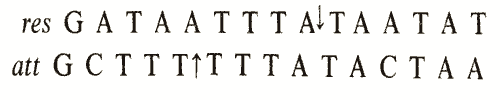
Стрелками показаны сайты, в которых белок TnpR разрезает локус res, а белок Int - att. Сами по себе реакции аналогичны, хотя здесь разрешение происходит только между внутримолекулярными сайтами, в то время как рекомбинация между att-сайтами является межмолекулярной и направленной (что обусловлено различиями att-сайтов). В обоих случаях очевидно сходство с реакциями разрезания и воссоединения, осуществляемыми топоизомеразами.
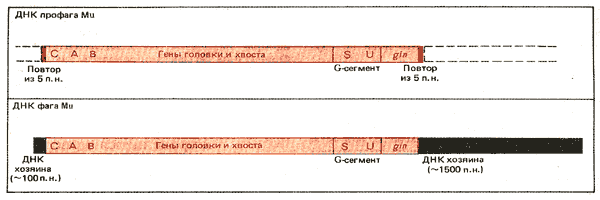
Рис. 36.13. Порядок генов в профаге и свободной ДНК фага Mu одинаков, но концы различны. ДНК профага фланкирована прямыми повторами из 5 пар оснований ДНК хозяина. Свобод ная фаговая ДНК содержит различные дополнительные последовательности в левом конце длиной в 100 пар оснований и в правом конце (1500 пар оснований).
Наконец мы должны упомянуть поразительный эффект транспозона TnЗ, получивший название иммунитета транспозиции. Плазмида, несущая транспозон Тn3, иммунна к внедрениям любого Тn3-элемента, вносимого на другой молекуле ДНК (хотя Тn3, по-видимому, способен транспозироваться в пределах плазмиды). Существует определенный лаг-период между внедрением Тn3 в новую плазмиду и установлением иммунитета. Эффект специфичен; он относится только к Тn3 и не предотвращает внедрения других транспозонов в плазмиду. Природа такого цис-действия на далеком расстоянии остается загадочной.
Некоторые необычные свойства транспозирующего фага Mu
Фаг Mu может находиться в клетке в альтернативных состояниях, осуществляя литический цикл или лизогенизируя клетку. Он был открыт благодаря его способности вызывать мутации в Е. coli.Мутации возникают при внедрении фагового генома, содержащего 37 т. п.н., в случайные сайты (с региональной специфичностью) бактериальной ДНК. При этом реверсий с доступной определению частотой не происходит.
Карта генома фага Mu показана на рис. 36.13. Внедренный геном Mu имеет тот же порядок генов, что и свободная фаговая ДНК, которая имеет линейную форму. (Следует отметить существующее отличие от фага лямбда, свободная линейная ДНК которого при инфекции образует кольцевую молекулу; в результате интеграции образуется линейный профаг, порядок генов которого является пермутированным относительно порядка генов свободной ДНК фага.) Линейные геномы фага Mu не содержат ни липких концов, ни повторов; поэтому не ясно, каким образом осуществляется согласованное действие концов во время интеграции. Возможно, что реакция зависит от гомологии, которая встречается на расстоянии примерно 100 пар оснований от каждого конца. Существование механизма, узнающего специфические концы интегрированной последовательности фага Mu, было обнаружено при открытии способности этого фага вырезаться. Реакция происходит только в том случае, если профаг Mu приобретает IS1-элемент. Механизм вырезания неизвестен, однако установлено, что в него включены как функции, кодируемые Mu, так и функции, контролируемые IS 1-элементом.
Концы свободной ДНК фага Mu обладают дополнительным материалом, который не является частью фагового генома. Фактически концы представлены последовательностями генома хозяина. Левый конец содержит около 100, а правый - около 1500 пар оснований (они обозначены соответственно как с- и S-концы). В отдельных молекулах ДНК фага Mu эти последовательности различны; они приобретаются при упаковке фага из предшественников, в которых фаговый геном фланкирован последовательностями хозяина. При внедрении фагового генома в бактериальную хромосому дополнительные области теряются.
Инфицирующая родительская ДНК фага Mu внедряется в геном хозяина неэффективно. Большинство молекул ДНК во время литического цикла сохраняет свои свободные концы. Менее 10% инфицирующих фаговых геномов внедряются. Однако во время репродуктивного цикла последовательности ДНК фага Mu внедряются эффективно. Этот парадокс показывает, что копии ДНК Mu, образуемые при репликации, способны внедряться в геном хозяина. В родственной реакции индукция профага Mu, ведущая к вступлению в литический цикл, не сопровождается вырезанием фаговой ДНК из хромосомы хозяина. Снова ведущую роль в этом цикле играет продукт репликации.
Связь между интеграцией и репликацией обнаружена при изучении мутантов фага Мu, неспособных к интеграции. Оказалось, что и репликация у этих мутантов нарушена. Мутации, определяющие такую дефектность фага, локализуются в одном из двух генов, А или В, необходимых для репликации фага. Таким образом, интеграция, по-видимому, зависит от функции репликации, а не от специальных рекомбинационных ферментов (как у фага лямбда).
Существуют два пути внедрения фага Мu. В результате простых внедрений Мu образуются лизогенные бактерии, содержащие профаги. Обнаружено присутствие прямых повторов из 5 пар оснований с каждой стороны от профага, что указывает на сходство этого события с транспозицией. Кроме того, в процессе литического развития почти все продукты Mu-опосредованной транспозиции имеют структуру коинтегратов. Нам не известно, являются ли простые внедрения и коинтеграты результатом альтернативных взаимодействий ДНК фага Мu с ДНК мишени или они представляют собой разные конечные продукты одного общего предшественника. Основные механизмы транспозиции фага Мu пока не изучены.
Другое необычное свойство фага Мu связано с наличием в его геноме, вблизи правого конца, сегмента G, или инвертируемого сегмента. Он имеет протяженность около 3 т. п. н. и в различных молекулах ДНК фага Мu представлен в различной ориентации. У фага, полученного в процессе литической инфекции штамма Е. coli К12, G-сегмент всегда находится в ориентации, получившей название G(+). Если же фаг получают в результате индукции, его ДНК может содержать G-сегмент либо в этой же, либо в противоположной, G(—), ориентации. Для осуществления инверсии требуется ген фага Мu, названный gin и локализованный сразу же за пределами G-сегмента.
Сегмент G содержит в своем составе гены, которые кодируют белки, вовлекаемые в процесс адсорбции фага. Ориентация сегмента влияет на экспрессию этих генов. В результате такого контроля фаги G(+) и G(—) обладают различной специфичностью в отношении бактериальных штаммов. Зависимость штаммовой специфичности от G-сегмента схематически изображена на рис. 36.14.
Сегмент G несет альтернативные наборы генов. В ориентации G(+) экспрессируются геныS и U. Их продукты позволяют фагу адсорбироваться на клетках Е. coli К12, но не Е. coli С. В ориентации G(—) выражаются гены S' и U'. Это дает возможность фагу адсорбироваться на клеткахЕ. coli С, но не К.
Установлено, что белок S имеет мол. массу 56000, U - 21 000, S' - 48 000 и U' - 26 000. Характерно, что их общая протяженность требует кодирующей последовательности 4 т. п. н., которая, по существу, длиннее, чем сам G-сегмент. Это свидетельствует о том, что гены должны перекрываться.
Пока не завершено определение последовательности инвертируемого сегмента, остается нерешенным вопрос и об организации двух наборов генов. Модель, представленная на рис. 36.14, предполагает, что альтернативные наборы находятся на комплементарных цепях ДНК. Ориентация сегмента определяет, какому набору экспрессироваться, поскольку промотор находится вне сегмента и обеспечивает транскрипцию только одной цепи в пределах сегмента.
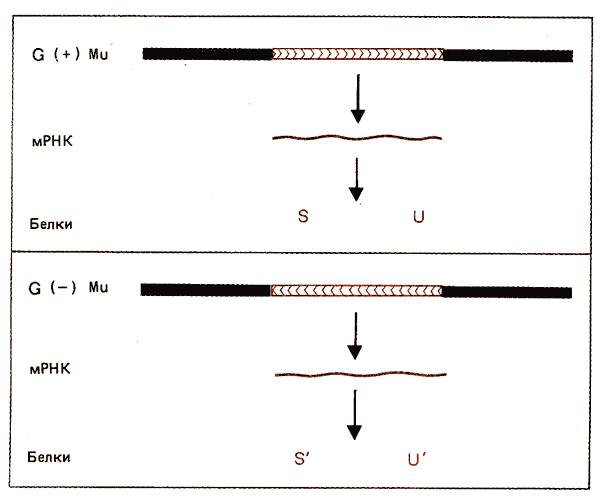
Рис. 36.14. Инверсия G-сегмента определяет, будут ли синтезироваться белки S и U или S' и U'. Одна из моделей предполагает, что их выражение инициируется слева от инвертируемого сегмента. Белки S и U должны кодироваться одной цепью ДНК инвертируемого сегмента, в то время как белки S' и U' кодируются комплементарной цепью.
Фазовая вариация у сальмонелл определяется инверсией
Движение бактерий осуществляется благодаря колебаниям их жгутиков. Многие виды сальмонелл являются дифазными, так как они обладают двумя неаллельными генами, контролирующими синтез флагеллина (белковой субъединицы жгутика). Определенный клон бактерий может относиться либо к HI-типу (бактерии находятся в фазе 1), либо к Н2-типу (бактерии в фазе 2). Переход от одной фазы к другой происходит примерно один раз на каждую 1000 бактериальных делений, и такая смена фаз получила название фазовой вариации.
Гены, кодирующие флагеллины двух типов, локализуются в различных участках хромосомы. Цикл контроля синтеза флагеллина изображен на рис. 36.15. Ген Н2 тесно сцеплен с другим геном (rhl), который кодирует репрессор синтеза HI. Эти два гена экспрессируются координированно. Если функционирует ген Н2, экспрессируется и ген репрессора, который предотвращает выражение гена HI. В тех случаях, когда не выражаются ни Н2, ни ген репрессора, происходит синтез HI. Таким образом, фаза бактерии определяется активностью транскрипционной единицы Н2—rhl.Экспрессия этой транскрипционной единицы зависит от ориентации сегмента ДНК, сцепленного с ней. Сегмент имеет протяженность, равную 995 п. н., и ограничен повторами длиной 14 п. н. (IRLn IRR). Инициирующий ко дон гена Н2 лежит на расстоянии 16 п. н. вправо от прилегающего инвертированного повтора. Сегмент ДНК между IRL и IRR содержит ген hin, продукт которого представляет собой транс-действующий белок, способствующий инверсии всего сегмента путем реципрокной рекомбинации между инвертированными повторами (рис. 36.9). Мутации в hin-гене уменьшают частоту инверсии в 10^ 4 раз.
Последствия реакции инверсии демонстрируются на рис. 36.16. Промотор транскрипционной единицы Н2—rhl лежит в пределах инвертируемого сегмента. В одной ориентации транскрипция инициируется в промоторе и продолжается в области Н2—rhl; при этом экспрессируется фаза 2. В другой ориентации промотор обращен в обратную сторону и транскрипционная единица не выражается (хотя транскрипция, по-видимому, происходит только в другом направлении и с неизвестными последствиями). Отсутствие транскрипции Н2—rhl обусловливает экспрессию фазы 1.
Таким образом, как в случае фазовой вариации, так и штаммовой специфичности Mu инверсия используется для регуляции экспрессии генов. При фазовой вариации процесс включения-выключения обеспечивается перемещением промотора относительно транскрипционной единицы. В случае фага Мu штаммовая специфичность обусловлена инверсией кодирующего сегмента относительно промотора, что приводит к экспрессии альтернативных генов.
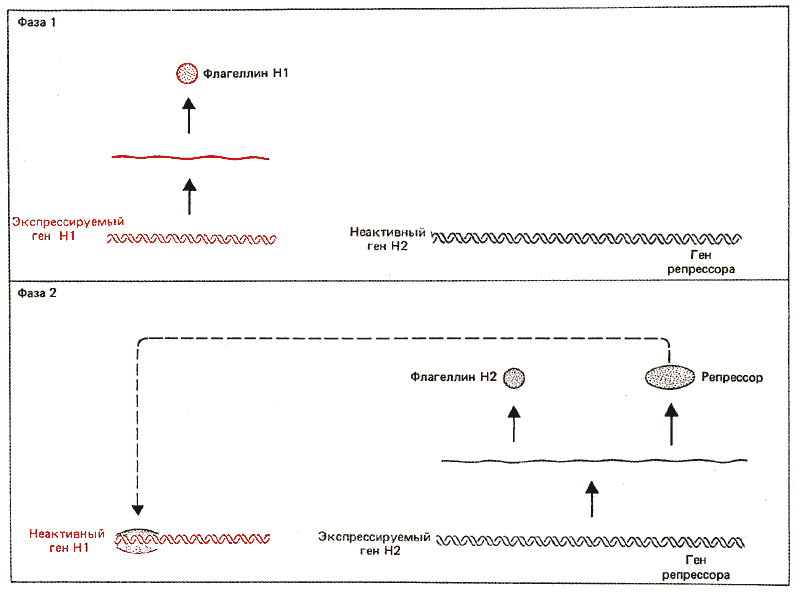
Рис. 36.15. Фаза у сальмонелл определяется активностью транскрипционной единицы Н2. В фазе 1 единица Н2 неактивна, в результате чего синтезируется флагеллин HI. В фазе 2 единица Н2 активна, синтезируются флагеллин Н2 и репрессор. Он и предотвращает выражение гена HI.
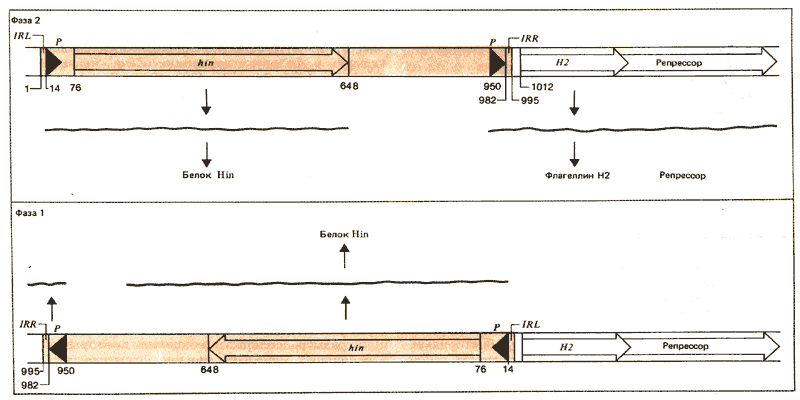
Рис. 36.16. Экспрессия флагеллинового гена Н2 и репрессора фазы 1 контролируется ориентацией инвертируемой области из 995 пар оснований. Фаза 2 проявляется, когда промотор, находящийся в положении 950, обеспечивает транскрипцию, идущую через последовательность IRR в Н2 единицу. Фаза 1 имеет место, когда промотор обращен в противоположную сторону. В обеих фазах ген hin экспрессируется со своего собственного промотора (местоположение которого не определено). Цифры указывают пары оснований в пределах инвертируемого сегмента.
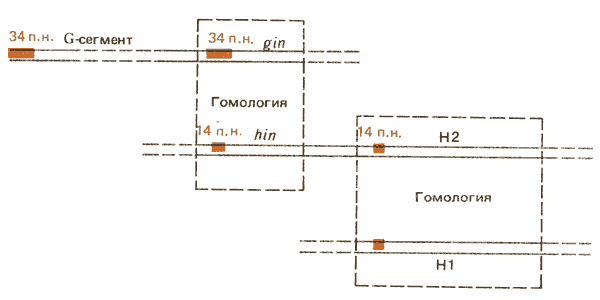
Рис. 36.17. Ген флагеллина Н2 гомологичен гену HI, и регуляторная область hin, расположенная перед геном Н2, гомологична гену ginбактериофага Мu.
При сравнении этих реакций друг с другом и с транспозицией TnЗ возникают некоторые параллели. Функция hin Salmonellaи gin-функция фага Мu могут замещать одна другую в комплементационных экспериментах. (Эти функции заменяет функция гена cin, ответственного за инверсию С-сегмента фага Р1). Несмотря на то что ген tnpR транспозона Тn3 не способен заместить какую-либо из этих последовательностей, аминокислотная последовательность резолвазы демонстрирует значительную гомологию с последовательностью аминокислот белка Hin.
Область перекреста для действия резолвазы проявляет гомологию с последовательностями IRL и IRR. Последовательность длиной в 34 пары оснований, включающая IRL, имеет только семь несоответствующих пар по сравнению с инвертированными повторами, лежащими в концах G-сегмента. Отсюда следует, что инверсия hin-сегмента Salmonella и G-сегмента фага Мu происходит с помощью сайтспецифической рекомбинации между инвертированными повторами, механизм которой имеет общие черты с реакцией, участвующей в разрешении коинтегратов Тn3.
Таким образом, эти стационарные инверсионные события могли эволюционировать при взаимообмене между транспозонами и бактериальными локусами, возможно, даже путем наследственной иммобилизации транспозирующихся элементов, функции которых стали ограниченными. Многообразие механизма рекомбинационной инверсии можно видеть при сравнении последовательностей вблизи генов Н2, HI, а также последовательности G-сегмента фага Мu. Данные суммированы на рис. 36.17. Флагеллиновые гены HI и Н2 весьма близки, и их гомология распространяется на области, расположенные против направления транскрипции от каждой кодирующей последовательности. Далее в этом же направлении лежит область, включающая ген hin, которая имеет тесную гомологию с областью локализации гена gin в геноме фага Мu. Таким образом, можно предположить, что между флагеллиновым геном Н2 и геном, кодирующим инверсионную функцию фага Мu, произошло наследственное слияние, приведшее к появлению системы контроля фазовой вариации.
Рекомендуемая литература
Развитие представлений о транспозонах может быть прослежено в обзорах Клекнер (Kleckner, Cell, 11, 11-23, 1977; Ann. Rev. Genet., 15, 341-404, 1981), Калоса и Миллера (Calos, Miller, 20, 579-595, 1980). Их роль в эволюции была рассмотрена в обзоре Кэмпбелла (Campbell, Ann. Rev. Microbiol., 35, 55-83, 1981). Оригинальная модель транспозиции, включающая образование коинтегратов, была представлена Шапиро (Shapiro, Proc. Nat. Acad. Sci. USA, 76, 1933-1937, 1979); последовательность и функции TnЗ проанализированы Хеффроном (Heffron et al, Cell, 18, 1153-1163). Две главы в книге "Mobile Genetic Elements" (ed. Shapiro, Academic Press, New York, 1983) посвящены отдельным транспозонам: TnЗ (написано Хеффроном) и Tn10 (автор Клекнер); глава, написанная Сильверманом и Симоном, связана с фазовой вариацией и инверсией сегмента фага Mu. Эти вопросы ранее рассматривались Симоном и соавт. (Simon, Science, 209, 1370-1374, 1980). Зиег и Симон расшифровали последовательность, вовлекаемую в фазовую вариацию (Zieg, Simon, Proc. Nat. Acad. Sci. USA, 74, 4196-4200, 1980). Данные об инвертируемом сегменте G кратко обсуждала в своей работе Хау (Howe, Cell, 21, 605-606, 1980).