
Б.ЛЬЮИН
Гены
Перевод с английского канд.биол.наук А.Л.Гинцбурга, д-ра биол.наук Т.С.Ильиной, канд. биол. наук Э.С.Каляевой и канд.биол.наук Т. Ю. Переслени
под редакцией чл.-корр. АН СССР Г.П.Георгиева
Москва «Мир» - 1987
Часть Х
ДИНАМИЧНОСТЬ ГЕНОМА: ПОСТОЯННОЕ ИЗМЕНЕНИЕ ДНК
Глава 38
Элементы, способные к перемещению в пределах генома и вне его
По всей вероятности, транспозоны не способны к существованию вне генома. Независимо от того, являются ли они компонентами, играющими важную роль в жизни клетки, или ее паразитами, занятыми только своим собственным воспроизведением, свободных молекул ДНК они не образуют. В этой главе мы познакомимся с элементами, способными существовать в составе генома и вне его; некоторые из них являются природными, другие образовались в результате рекомбинации в лабораторных условиях.
В отдельных случаях последовательность РНК служит предшественником геномной последовательности (ДНК). Вероятно, РНК должна была превратиться в двухцепочечную ДНК, которая затем внедрялась в геном с помощью события, напоминающего транспозицию. Прямое указание на существование такого пути получено при изучении ретровирусов, у которых такой путь представляет собой часть обычного инфекционного цикла. Структура некоторых псевдогенов и других последовательностей (включая членов семейства Alu) свидетельствует, что аналогичный путь может быть пройден клеточной последовательностью (достаточно редко). В обоих случаях внехромосомный элемент дает начало геномной последовательности.
Изменения в относительном соотношении компонентов генома иногда происходят во время соматического развития. Хорошо известно, например, увеличение числа копий определенных генов у личинок насекомых. Благодаря возможности отбирать варианты клеток с увеличенным числом копий определенного гена показана случайная амплификация генов в культуре клеток млекопитающих. Инициируемое внутри генома событие амплификации способствует созданию дополнительных копий гена, которые существуют либо в составе хромосомы, либо в форме внехромосомных элементов.
Открытию транспозиции и других перестроек в ДНК в какой-то мере способствовали наши знания об удивительной способности последовательностей ДНК приспосабливаться. Чужеродную ДНК можно ввести в эукариотические клетки, где она выживает и может экспрессироваться. В некоторых случаях чужеродная ДНК остается внехромосомной, иногда она интегрируется в геном. Взаимоотношения между внехромосомными и геномными формами необычны и скорее зависят от случайных и в некоторой степени непредсказуемых событий, чем напоминают взаимный обмен между свободными и интегрированными формами бактериальных плазмид. Тем не менее процесс может привести к стабильному изменению в геноме. Например, ДНК, инъецированная в яйцеклетки животных, способна включаться в геном, наследоваться и функционировать. Благодаря этому оказывается возможным осуществлять весьма сложные манипуляции с последовательностями ДНК как в природных, так и в экспериментальных условиях.
Геном ретровирусов представлен одноцепочечной РНК, которая реплицируется в виде промежуточной двухцепочечной ДНК. Класс ретровирусов, о котором мы имеем самую большую информацию, характеризуется способностью образовывать в клетках птиц и млекопитающих частицы С-типа. В каждом вирионе упакованы две копии генома РНК, в результате чего каждая отдельная вирусная частица фактически диплоидна. Если клетка одновременно инфицирована двумя различными вирусами С-типа, можно получить гетерозиготные вирусные частицы, несущие по одному геному каждого типа. Диплоидность может влиять на возможность приобретения вирусом клеточных последовательностей. Типичная последовательность ретровируса содержит три «гена». Под этим термином в данном случае мы понимаем кодирующие области, каждая из которых на самом деле дает начало множеству белков в ходе процессинга. Порядок генов, gag—pol—env, приведен в верхней части рис. 38.1. Вирусная РНК транслируется как обычная информационная РНК (она содержит кэп на 5'-конце и poly(A) на З'-конце) в полибелок Gag.
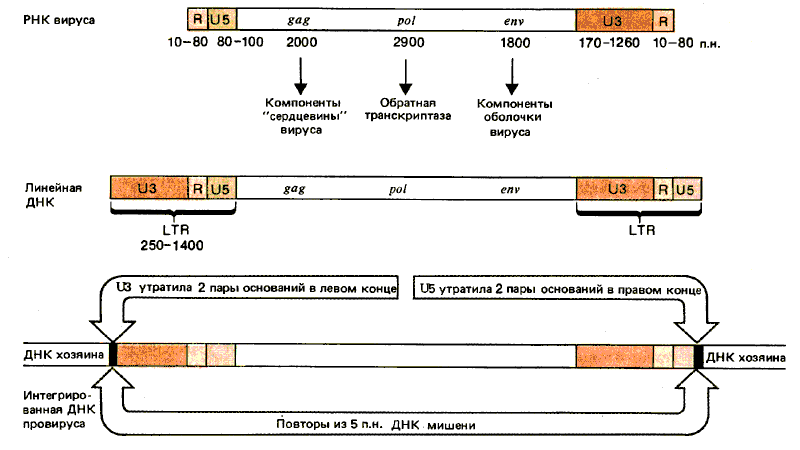
Рис. 38.1. Ретровирусные РНК кончаются прямыми повторами (R), а свободные линейные ДНК-последовательностями LTR; концы провирусов представляют собой LTR-последовательности, укороченные на два основания.
Одна из информационных РНК, в результате сплайсинга утратившая терминирующий кодон в гене gag, транслируется с образованием белка Gag—Pol. Сплайсинг также способствует образованию более коротких субгеномных информационных РНК, которые при трансляции образуют полипротеин Env, предшественник двух белков.
Ген gag дает начало белковым компонентам нуклеопротеинового ядра вириона. Ген env кодирует компоненты вирусной оболочки, которая захватывает также компоненты клеточной цитоплазматической мембраны. Ген pol кодирует фермент, получивший название обратной транскриптазы, который состоит из двух субъединиц. Одна из субъединиц представляет собой образующийся при процессинге фрагмент другой субъединицы. Соответственно названию фермент осуществляет превращение РНК-генома в комплементарную цепь ДНК. Он катализирует также последующие стадии при образовании двухцепочечной ДНК, обладает ДНК-полимеразной активностью, ведет себя подобно РНКазе Н (способен деградировать РНК, входящую в состав гибрида РНК—ДНК) и обладает эндонуклеазной активностью.
Обратная транскриптаза упаковывается вместе с геномом в вирусную частицу. Фермент превращает РНК в линейную двухцепочечную молекулу в цитоплазме инфицированной клетки. Линейная ДНК самостоятельно проникает (неизвестным способом) в ядро, где она превращается в кольцевую молекулу. Одна или несколько копий ДНК интегрируют в геном хозяина. Интегрированная провирусная ДНК транскрибируется аппаратом хозяина с образованием вирусных РНК, которые затем используются как в качестве мРНК, так и в качестве геномов для упаковки в вирионы. Интеграция представляет собой нормальный этап жизненного цикла вируса и необходима для транскрипции.
Структуры различных форм ДНК вируса сравниваются с РНК на рис. 38.1. Вирусная РНК содержит прямые повторы на концах. В различных штаммах вируса длина таких R-сегментов варьирует от 10 до 80 нуклеотидов. Рядом с R-сегментом в 5'-конце вирусного генома находится область U5, состоящая из 80-100 нуклеотидов. Ее название свидетельствует о локализации этой последовательности на 5'-конце. В З'-конце R-сегменту предшествует уникальный сегмент U3, содержащий 170-1250 нуклеотидов.
Концы линейной ДНК содержат дополнительные последовательности. Сегмент U3 добавляется к 5'-концу; сегмент US - к З'-концу. В результате каждый конец ДНК имеет последовательность U5—R—U3; она получила название длинного концевого повтора (LTR). Ее образование связано с реакцией, схема которой представлена на рис. 38.2. Обратная транскриптаза переключает матрицы, перенося образующуюся ДНК на новую матрицу. На рисунке показано образование одного LTR; для образования повтора на другом конце требуется подобное событие. Характерная черта вирусного генома - идентичность LTR, находящихся на его концах. Это объясняется их происхождением. З'-конец U5 состоит из короткого инвертированного повтора, родственного 5'-концу последовательности U3, в результате чего сама последовательность LTR фланкирована короткими инвертированными повторами. Следовательно, организация ДНК ретровируса напоминает организацию транспозирующихся элементов, подобных copia (см. рис. 37.2).
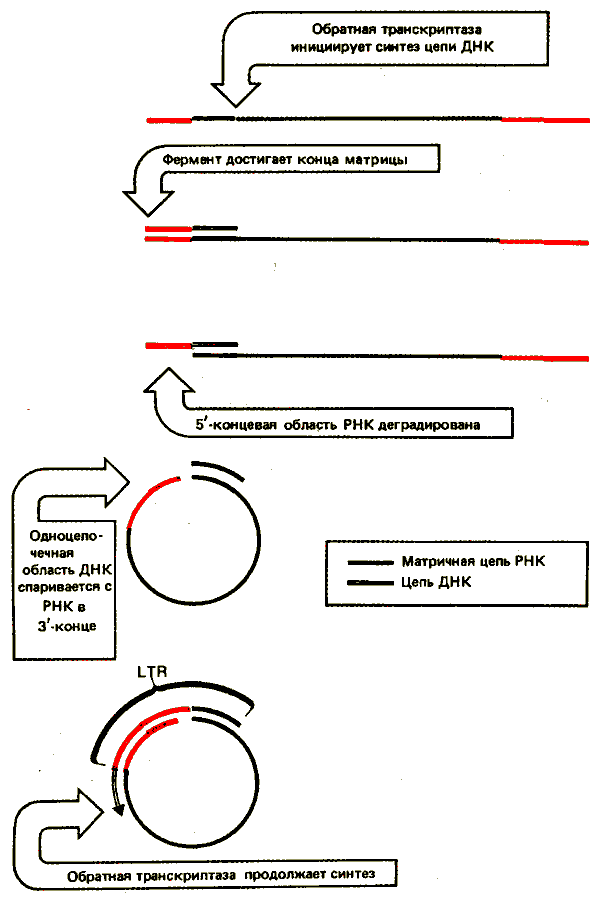
Рис. 38.2. Последовательности LTR образуются при переключении матриц во время обратной транскрипции. Новая матрица может быть другим концом той же молекулы (как показано на рисунке) или другой молекулой.
Жизненный цикл ретровирусов схематически изображен на рис. 38.3. События, происходящие в период между образованием линейной ДНК и ее интеграцией, еще недостаточно хорошо изучены. После внедрения в ядро линейная ДНК дает начало двум формам кольцевых ДНК. (Число кольцевых молекул в разных штаммах колеблется от 0,1 до 5 копий на клетку.) Обнаружены две основные формы мономерных замкнутых кольцевых ДНК. Наиболее часто встречаемая форма содержит одну копию LTR, что может объясняться ее происхождением в результате гомологичной рекомбинации между двумя LTR. (Мы не знаем, действительно ли она образуется благодаря такому механизму, но одиночные LTR, которые могут быть последствиями вырезания провирусов, существуют в некоторых клеточных геномах.) Менее часто встречающаяся форма содержит две тандемные копии LTR; иногда они соединены непосредственно, как в случае лигирования тупых концов; иногда в одном или обоих концах LTR в местах соединения утрачены нуклеотиды. Роль таких кольцевых молекул в процессе интеграции еще не выяснена. Необходимо вновь подчеркнуть их сходство с кольцевыми молекулами элементов copia, найденными у D. melanogasterl (гл. 37).
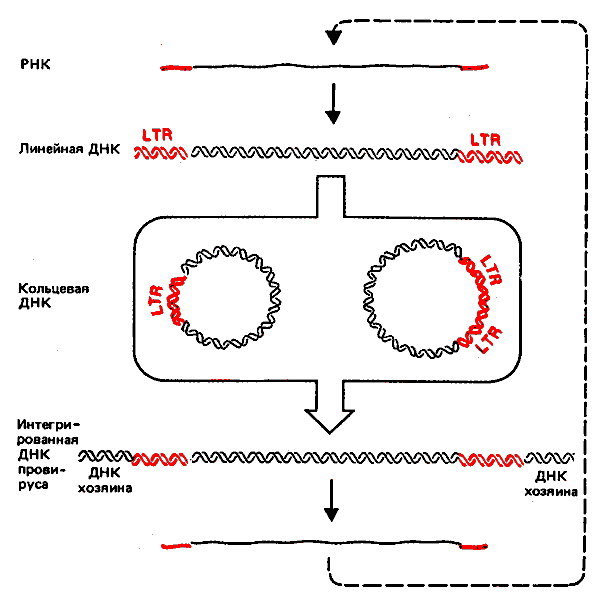
Рис. 38.3. Интеграция ретровируса сопровождается образованием двух типов кольцевых молекул ДНК.
Вирусная ДНК встраивается в случайные сайты генома клетки-хозяина. Инфицированная клетка содержит от одной до десяти копий провируса. В каждом сайте внедрения образуются короткие прямые повторы ДНК мишени. Их длина у разных вирусов может быть равна 4, 5 или 6 парам оснований. Наличие прямых повторов свидетельствует о том, что механизм интеграции включает образование ступенчатых разрезов в ДНК хозяина, аналогичных тем, которые образуются при бактериальной транспозиции. Сайт интеграции специфичен в отношении вируса, и интегрированная ДНК отличается от неинтегрированной двумя парами оснований в каждом конце. Таким образом, интегрированная вирусная ДНК утрачивает две пары оснований в левом конце 5'-концевой последовательности U3 и две пары оснований в правом конце З'-концевой последовательности U5.
Область U3 каждого LTR несет промотор. Промотор в левом LTR ответствен за инициацию транскрипции провируса. Иногда (довольно редко) промотор в правом LTR способствует транскрипции последовательности хозяина, прилегающей к сайту внедрения. Интеграция генома ретровируса может обусловливать опухолевую трансформацию клеток путем активации определенных типов клеточных генов.
Способность «включать» фланкирующие последовательности хозяина аналогична свойству некоторых бактериальных транспозонов, хотя способность к включению может быть иногда обусловлена скорее наличием усилителя (enhancer), чем промоторными последовательностями. Активность провирусного генома, вероятно, зависит и от сайта, в котором произошла интеграция вируса в геном хозяина.
До сих пор мы имели дело с ретровирусами в условиях инфекционного цикла, когда для образования новых копий РНК необходим процесс интеграции. Однако при интеграции вируса в клетку зародышевой линии его эффективная экспрессия прекращается, он способен стать наследственным эндогенным вирусом организма. Такое состояние вируса более всего изучено у мышей и цыплят, чьи геномы несут неактивные эндогенные вирусы. Иногда эндогенные вирусы активируются внешними факторами. Одним из таких факторов является инфекция клетки другим вирусом.
Обнаружение трансдуцирующих вирусов, геномы которых приобрели клеточные последовательности, позволило взглянуть на жизненный цикл вируса с несколько другой точки зрения. На рис. 38.4 показан геном одного из таких вирусов. Часть вирусной последовательности - в данном случае ген env - замещена геном v-oncl. Образовавшийся вирус дефектен по репликации и не способен поддерживать самостоятельно инфекционный цикл. Такой вирус может сохраняться вместе с вирусом-помощником, который восполняет утраченные вирусные функции.

Рис. 38.4. у дефектных в отношении репликации трансформирующих вирусов часть вирусной последовательности замещена последовательностью клетки. Длина замещенной последовательности характерна для каждого вируса.
Название гена onc (от англ, oncogenesis) связано с названием процесса, который он вызывает: онкогенез или опухолевая трансформация культивируемых клеток. Она выражается в нарушении регуляции роста и вследствие этого в неограниченном делении клеток. За появление опухолеродных клеток могут быть ответственны как вирусные, так и клеточные onc-гены.
Гены onc, входящие в состав генома ретровирусов, получили название v-onc, и именно они придают вирусу способность трансформировать определенный тип клеток хозяина. Локусы с гомологичными последовательностями, найденные в геноме хозяина, получили название с-onc-генов. В большинстве случаев о функциях клеточных генов ничего не известно. Однако в некоторых экспериментах по трансфекции были идентифицированы активные с-опс-гены. Их добавление к реципиентным клеткам вызывало трансформацию последних. Такие гены могут быть активированы и при интеграции вблизи них генома ретровируса, как это описано в предыдущем разделе. Существует большая группа оnс-генов. Отдельным членам этой группы даны названия, соответствующие названиям вирусов, в которых они впервые были обнаружены (например, src-ген выделен из вируса саркомы Рауса, fes - из вируса саркомы кошек и т.д.).
Каким образом ретровирусы приобрели гены оnс? Некоторое представление об этом дает различие, обнаруженное в структуре генов с-оnс и v-оnс. Гены с-оnс обычно прерываются интронами, и их экспрессия в клетке происходит на низком уровне. Гены v-оnс непрерывны и экспрессируются эффективно как часть вирусной единицы транскрипции. Сравнение их структур позволило предположить, что гены v-оnс образовались в результате сплайсинга копий РНК генов с-оnс.
Первые гипотезы о происхождении трансформирующих вирусов основывались на допущении возможности случайной упаковки клеточных мРНК в вирионе вместе с геномом вируса; затем должна была иметь место гомологичная рекомбинация между РНК, в результате которой могли возникнуть трансформирующие вирусные геномы. Однако данную модель пришлось пересмотреть. Для этого были две причины. Во-первых, c-оnс-последовательности обнаружены в виде редко встречающихся мРНК, в которых отсутствуют сигналы упаковки. Во-вторых, на уровне РНК осуществление рекомбинационных событий кажется маловероятным.
Существующая в настоящее время модель образования трансформирующих вирусов представлена на рис. 38.5. Предполагается, что ретровирус встроился вблизи c-оnс-гена. В результате делеции происходит слияние генома провируса с геном с-оnс, затем транскрипция ведет к образованию объединенной РНК, содержащей вирусные последовательности в одном конце и клеточные последовательности оnс в другом. В результате сплайсинга удаляются интроны как в вирусной, так и в клеточной частях молекулы. РНК имеет соответствующие сигналы для упаковки в вирионы. Вирионы могут образовываться, если в клетке содержится другая, интактная, копия провируса. В этих случаях некоторые диплоидные частицы вирусов содержат одну слившуюся и одну вирусную РНК.
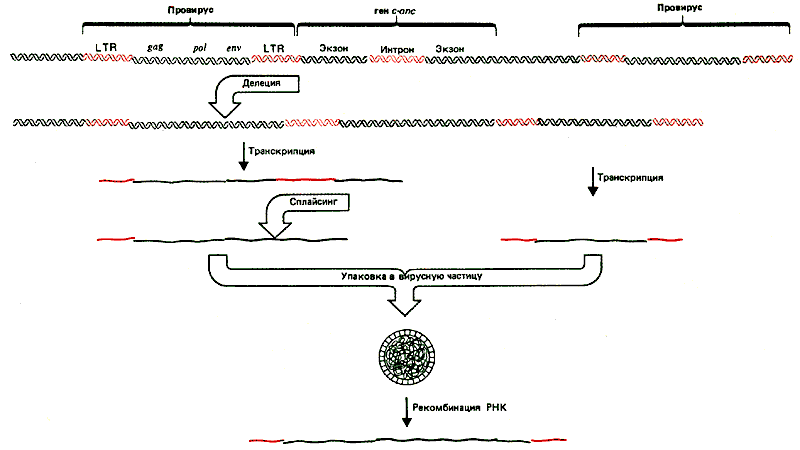
Рис. 38.5. Дефектные в отношении репликации вирусы могут возникать благодаря интеграции и делеции вирусного генома, в результате чего образуются слившиеся вирусно-клеточные транскрипты, которые упаковываются вместе с нормальным РНК-геномом. В образовании дефектного по репликации трансформирующего генома участвует процесс негомологичной рекомбинации.
Рекомбинация между этими последовательностями может привести к образованию трансформирующего генома, в котором повторы вируса присутствуют в обоих концах. (Рекомбинация происходит с высокой частотой во время инфекционного цикла ретровируса; по-видимому, в ней используются промежуточные продукты ДНК или дополнительные реакции переноса цепи. Можно предположить, что между вирусным геномом и клеточной частью слившихся РНК происходит негомологичная рекомбинация при участии того же механизма, который ответствен за рекомбинацию ретровирусов.) Какова связь между ними и транспозируемыми элементами? Обнаружена существенная гомология в последовательностях LTR вируса лейко-саркомы птиц AL-SV и прямых концевых повторов copia-подобных элементов 297 и 17.6 у Drosophila. Возможно copia-подобные элементы возникли в результате иммобилизации ретровирусов?
Могли ли ретровирусы произойти от клеточных элементов? Основные свойства, характеризующие всю группу ретровирусов, позволяют высказать предположение о наличии у них общего предшественника. Их сходство с транспозирующимися элементами свидетельствует о том, что изначально с обеих сторон от гена клетки-хозяина, кодирующего полимеразу нуклеиновой кислоты, могли оказаться IS-подобные элементы; в этом случае образовавшаяся единица должна иметь структуру LTR—pol—LTR. Эта структура затем могла приобрести полимеризующую активность, позволяющую манипулировать с ДНК- и РНК-субстратами, и таким образом эволюционировать в ретровирус. Трансформирующие гены могли быть включены позднее. (Нет оснований полагать, что механизм, участвующий в приобретении клеточных функций, является уникальным для трансформирующих генов; однако такие вирусы могли иметь селективное преимущество благодаря их влиянию на рост инфицированных клеток.)
Некоторые псевдогены проявляют такие внешние и внутренние признаки, которые свидетельствуют о возможности их происхождения из последовательности РНК, хотя относительно образования ДНК-копий таких генов можно высказать лишь гипотезы. Характерные признаки таких псевдогенов сравниваются на рис. 38.6 с признаками исходного гена и мРНК. На рисунке представлены все диагностические признаки, однако в каждом конкретном случае обнаружить можно лишь некоторые из них.
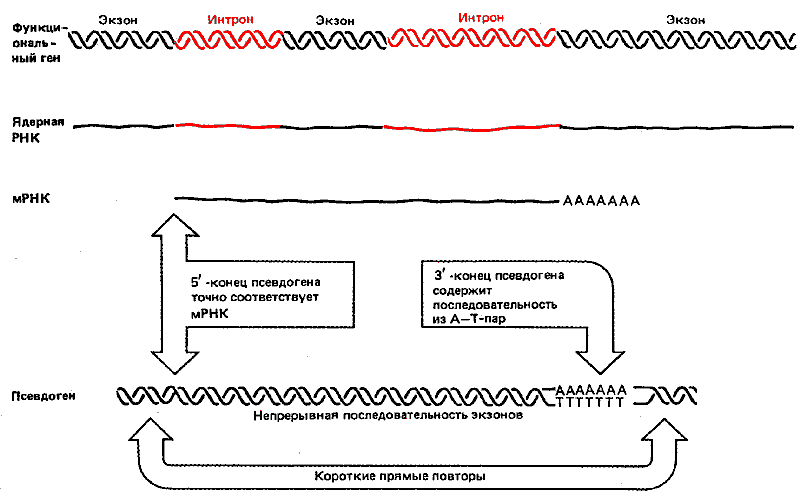
Рис. 38.6. Псевдогены могли возникнуть в результате обратной транскрипции РНК, ведущей к образованию двухцепочечных ДНК, которые интегрировали в геном.
Начало псевдогена соответствует точке, эквивалентной 5'-концу РНК, и именно это свидетельствует о происхождении его ДНК из РНК. Несколько псевдогенов состоят из точно сочлененных последовательностей экзонов; поскольку известно, что не существует механизма, позволяющего узнавать последовательности нитронов в ДНК, такая особенность доказывает посредничество РНК при образовании псевдогенов. Псевдоген может оканчиваться короткой областью из А—Т-пар оснований, образовавшейся, по-видимому, из роlу(А)-хвостовой части РНК. С обеих сторон от псевдогена имеются короткие прямые повторы. Возможно, что их присутствие - результат события, напоминающего транспозицию. Подтверждением гипотезы, что эти псевдогены произошли с помощью иного механизма, нежели тот, который ответствен за образование псевдогенов, найденных вблизи активных членов генных кластеров, служит факт обнаружения псевдогенов в местах, не связанных с их предполагаемыми исходными сайтами локализации.
Если псевдоген произошел из последовательности мРНК, его гомология в 5'-конце не может распространяться на последовательность, расположенную выше сайта инициации, как это показано на рис. 38.6. Однако a-глобиновый псевдоген мыши в действительности имеет некоторую гомологию с активным геном в области, расположенной выше точки инициации. Модель процессинга можно было объяснить, допустив, что инициация происходит в более отдаленном участке, расположенном в направлении против хода транскрипции, в результате чего образуется более длинная РНК (либо вследствие инициационного события, отклоняющегося от нормы, либо вследствие локализации промотора в другой области).
Другие последовательности, напоминающие по своим свойствам транспозоны, - это члены семейства Alu. Они фланкированы короткими прямыми повторами, однако длина повторов у отдельных членов семейства различна. Вставка в Alu-последовательность, ответственная за образование малой ядерной РНК, также, по-видимому, является результатом транспозиционного события. Свидетельства давно происшедших транспозиционных событий можно обнаружить и в генах нескольких малых ядерных РНК.
Все рассмотренные примеры отличаются от ретровирусов: предполагаемые транспозируемые последовательности сами по себе не несут какой-либо информации для транспозиционного события (или обратной транскрипции РНК). Мог ли этот процесс осуществляться с помощью ретровирусов? Происходило ли это с участием клеточной системы? Не исключено, что концы транспозируемых последовательностей случайно напоминали последовательности концов транспозона. Происходит ли в этих генах транспозиция в настоящее время, или мы видим последствия давно прошедших событий?
Состав генома в большинстве соматических клеток сохраняет постоянство. Однако теперь мы знаем о некоторых ситуациях, при которых происходят изменения в соотношении отдельных последовательностей. Наиболее известны изменения во время развития личинок у насекомых. Регуляция ведет к образованию недореплицировавшихся или избыточно реплицировавшихся специфических последовательностей.
Недорепликация встречается при формировании политенных тканей мухи. В таких тканях образуются гигантские хромосомы (гл. 28); их возникновение обусловлено множественными последовательными дупликациями исходного (синаптированного) диплоидного набора хромосом.
Примерно четверть генома D. melanogaster приходится на гетерохроматиновую область хромосом, которые агрегируют с образованием хромоцентра (большая его часть состоит из последовательностей сателлитной ДНК). Относительное количество гетерохроматина в политенных клетках значительно меньше, чем в клетках диплоидов. Это объясняется тем, что часть генома не способна дуплицироваться во время политенизации последовательностей ДНК эухроматина. Измерение содержания сателлитной ДНК показывает, что эти последовательности не дуплицируются или дуплицируются лишь несколько раз по сравнению с девятью дупликациями эухроматиновой ДНК в слюнной железе.
Гены рРНК также относятся к недореплицированным в политенных тканях. Область рДНК дуплицируется только 6—7 раз (достигая одного и того же конечного уровня независимо от того, присутствует только один ядрышковый организатор или оба). Такой тип дозового контроля специфичен для рДНК.
Соответственно контролю репликации в политенных тканях геном D. melanogaster может быть разделен на три типа областей. Естественно предположить, что точки начала репликации в каждом типе контролируют число инициационных событий. Точки начала репликаций в сателлитной ДНК могут не узнаваться; точки начала репликации в рДНК прекращают функционировать в ответ на действие некоторых конечных продуктов ряда генов рРНК; в то же время инициация в общих точках начала репликации эухроматина продолжается вплоть до самого конца.
У насекомых также наблюдается дифференциальная амплификация определенных последовательностей, кодирующих белок. В слюнных железах Rhyncosciara и других сциарид образуются пуфы ДНК. Внешне они напоминают пуфы, которые представляют активные области политенных хромосом дрозофил, однако пуфы сциарид содержат локально амплифицированную ДНК, а также РНК. Амплифицированные последовательности могли четыре раза подвергаться дополнительным инициационным событиям репликации, в результате чего число копий увеличивалось в 16 раз.
Пониманию возможных механизмов дифференциальной амплификации способствует состояние генов хориона при развитии D. melanogaster. Белки, составляющие хорион (оболочку яйца), синтезируются и секретируются полиплоидными клетками яйцевого фолликула. Гены хориона насекомых имеют тенденцию к группировке; у D. melanogaster идентифицированы две группы таких генов. До экспрессии в клетках фолликула гены хориона в Х-хромосоме амплифицируются шестнадцатикратно (четыре дополнительных удвоения), тогда как гены в хромосоме III амплифицируются до 60 раз (шесть дополнительных удвоений).
Амплификация всегда распространяется на расстояние, равное примерно 45-50 т. п. н. с каждой стороны от генов хориона. Уровень максимальной амплификации представляет плато, образованное примерно 20 т. п. п., окружающими гены хориона. Степень амплификации показывает градиент уменьшения с каждой стороны от плато.
Чем обусловлена амплификация? Градиент уменьшения показывает, что концевые точки амплифицируемых областей в отдельных молекулах гетерогенны. Для объяснения происходящих событий предложена модель, представленная на рис. 38.7. В соответствии с ней в точке начала репликации в центре области происходят множественные инициационные события, ведущие к двунаправленной репликации. Репликационные вилки продвигаются вперед на расстояния от 10 до 50 т. п. н. Эта модель рассматривает всю амплифицируемую область как репликон, представленный множеством только частично реплицировавшихся копий. (Взаимосвязь между частично реплицировавшимися и многократно реплицировавшимися областями в хромосомах слюнных желез могла бы быть объяснена подобной моделью, в которой места соединения между областями представлены неподвижными репликационными вилками.)
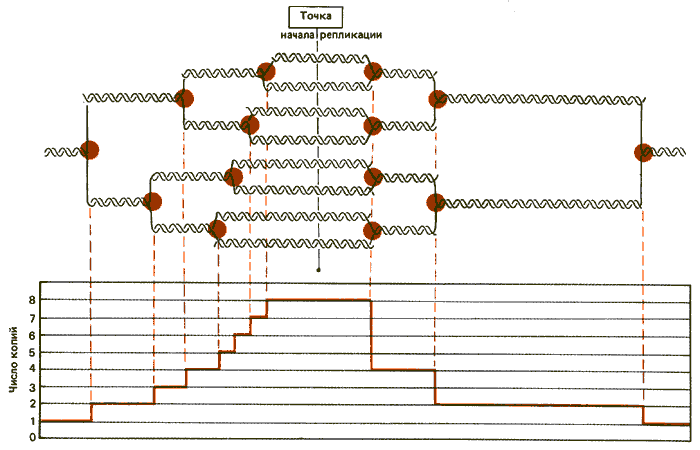
Рис. 38.7. Амплификация локальной области могла происходить путем множественных событий инициации в пределах одного репликона. Каждая реплицированная область соединена с фланкирующими нереплицированными участками неподвижными репликационными вилками. Если вилки прекращают движение в случайных точках, они образуют по степенный градиент (левая часть рисунка). Если отдельные вилки прекращают движение координированно в фиксированном сайте, они вызывают одновременное уменьшение в уровне амплификации (правая часть рисунка).
Содержит ли амплифицированная область точку, ответственную за начало репликации и активную в цис-положении? Если да, то амплификация не происходила бы в хромосоме с мутировавшей точкой начала репликации. В гетерозиготе такая дефектность па репликации должна проявляться только в мутантной хромосоме. В случае транслокации точки начала репликации в другую область она должна была бы обеспечивать амплификацию любого репликона, в котором она оказалась.
Свойства мутанта с дефектным строением глазных фасеток (ocelliless) подтверждают такое предсказание. Эта мутация вызывает сложные изменения в фенотипе; она представляет собой инверсию примерно трех дисков, содержащих область генов хориона в Х-хромосоме. Гены хориона локализуются в пределах 3 т.п.н. левого конца инверсии.
Инверсия определяет основное изменение, проявляющееся в характере амплификации. На рис. 38.8 сравниваются области, амплифицированные в клетках мух дикого и мутантного типов. Область длиной 40 т.п.н. слева от точки разрыва инверсии вообще не способна амплифицироваться. 50 т.п.н., находящихся с другой стороны, амплифицированы, хотя уровень амплификации уменьшен и составляет примерно половину от обычного максимального уровня. (Причина уменьшения уровня амплификации неизвестна.) Более того, амплификация теперь распространяется в новые области, что видно по увеличению числа копий последовательностей справа; эти последовательности не амплифицировались в клетках дикого типа. Полученные результаты показывают, что точка начала репликации, способная обеспечить двунаправленную амплификацию, находится по соседству от генов хориона. Протяженность амплифицированной области остается одинаковой независимо от того, находится ли точка начала в обычном месте в штамме дикого типа или перемещена в новое положение в результате инверсии у мух линии ocelliless, характеризующейся нарушением строения глаз.
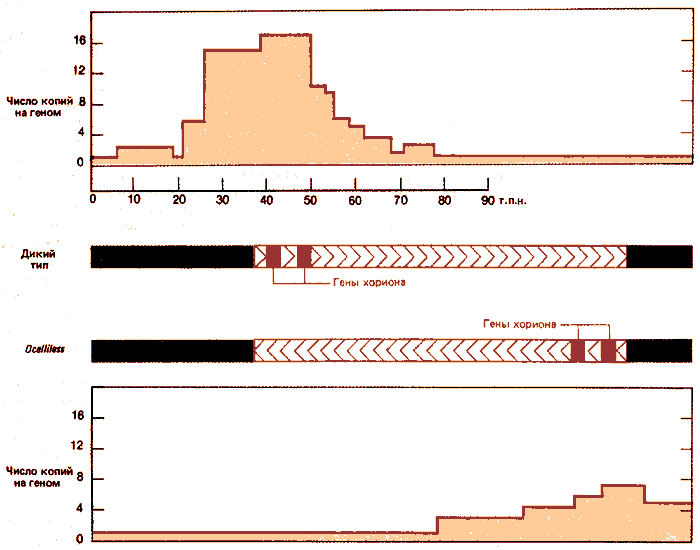
Рис. 38.8. Инверсия, вызывающая нарушение строения глаз у дрозофилы (ocelliks) (отсутствие глазков), изменяет область ДНК, которая амплифицируется. Левый конец инверсии находится на расстоянии, не превышающем 3 т.п.н. от левой пограничной области генов хориона; положение правого конца неизвестно, однако на рисунке длина инверсии равна примерно 85 т.п.н.
Классический тип эффекта, вызываемого инверсией, — феномен эффекта положения. Под этим термином понимают зависимость экспрессии гена от его положения в геноме. Хорошо известно, например, что при транслокации гена из эухроматинового района в гетерохроматиновый активность утрачивается. Хотя ген сам по себе остается неизменным, его активность под влиянием окружения меняется. В случае мутации ocelliless инверсия определяет неспособность некоторых генов амплифицироваться, в то время как другие гены начинают амплифицироваться вместо них. Дозовые эффекты вызывают сложные изменения в фенотипе без какого-либо изменения самих генов.
Геном эукариот обладает способностью накапливать дополнительные последовательности экзогенного или эндогенного происхождения. Такие последовательности независимо от того, добавлены ли они извне или имеют хромосомное происхождение, могут давать начало множественным копиям, которые существуют в виде тандемных последовательностей либо вне хромосомы, либо в составе хромосом. Находясь вне хромосом, дополнительный материал наследуется неравномерно (он не сегрегирует поровну при делении, как это свойственно истинным плазмидам). Материал, включенный в геном хозяина, является его компонентом.
Способ введения экзогенной донорной ДНК в клетки реципиента получил название трансфекции (см. следующий раздел). Селекция клеток на устойчивость к определенным агентам приводит к амплификации эндогенных последовательностей. Механизмы, обеспечивающие способность приспосабливаться при трансфекции и при амплификации, по-видимому, сходны. Нам ничего не известно о ферментативных активностях, участвующих в этом процессе, однако вероятно, что они выполняют родственные функции в обычном процессе воспроизведения ДНК.
Наиболее изучена амплификация генов при добавлении метотрексата (mtx) к какой-либо культивируемой клеточной линии. Реагент блокирует метаболизм фолята. Устойчивость к нему может обеспечиваться мутациями, которые изменяют активность фермента дигидрофолятредуктазы (DHFR). Наряду с изменением самого фермента может возрастать его количество в клетке. Причиной такого увеличения служит амплификация структурных генов dhfr.
Хотя амплификация относительно редко используется для приобретения резистентности к токсическому реагенту, она не уникальна для генов dhfr. Резистентность к ингибитору фермента аспартат-карбоилтрансферазы также приобретается благодаря амплификации соответствующего структурного генома. Клетки, устойчивые к тяжелому металлу кадмию, содержат увеличенное число копий гена, который кодирует белок металлотионеин, осуществляющий обезвреживание яда. Общей чертой всех трех систем является не единовременное (одноступенчатое) возникновение высокоустойчивых клеток, а постепенное в процессе адаптации к возрастающим дозам токсического реагента. Следовательно, амплификация генов может происходить в несколько стадий.
Число генов dhfr в линии клеток, устойчивых к метотрексату, варьирует от 40 до 400 в зависимости от строгости селекции и индивидуальной клеточной линии. Линии клеток mtxr можно отнести к двум классам, отличающимся своим ответом на отсутствие метотрексата в среде, когда потребность в высоких уровнях активности DHFR снимается. В стабильных линиях амплифицированные гены сохраняются. В нестабильных линиях амплифицированные гены по крайней мере частично утрачиваются при снятии селективного давления. Причиной таких различий, несомненно, служат условия, в которых находятся в них амплифицированные гены dhfr (рис. 38.9).
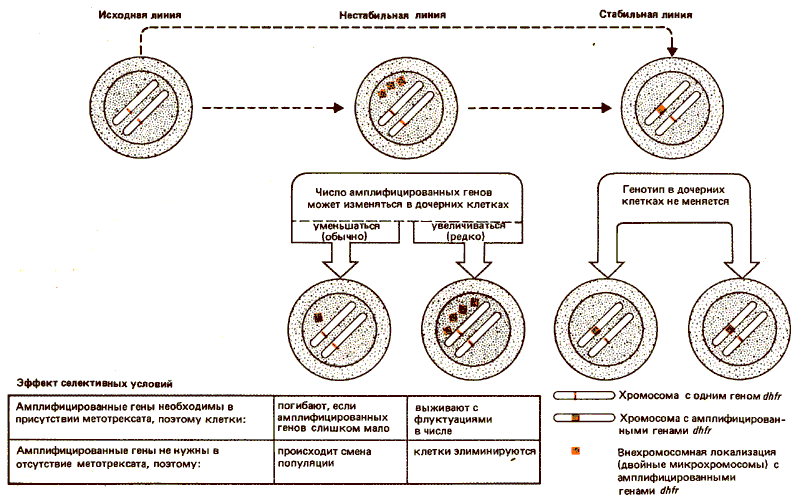
Рис. 38.9. Ген dhfr может быть амплифицирован, в результате чего образуются дополнительные копии, которые могут быть внехромосомными (нестабильными) или хромосомными (стабильными).
В стабильной линии клеток mtxr амплифицированные гены являются хромосомными и занимают обычный сайт dhfr на одной из хромосом. Как правило, другая хромосома сохраняет свою единственную копию dhfr. Таким образом, амплификация происходит только в одном из двух аллелей dhfr и возросшая устойчивость к метотрексату сопровождается дальнейшим увеличением степени амплификации этого локуса. (Однако иногда хромосома с амплифицированным локусом dhfr сама дуплицируется, по-видимому, в результате нерасхождения при митозе.)
Амплификация гена оказывает видимый эффект на хромосому; локус можно идентифицировать визуально как гомогенно окрашенную область (HSR). Это показано на рис. 38.10. HSR получила свое название из-за присутствия дополнительной области, в которой хромосомные полосы при соответствующих обработках, например при С-окрашивании, выявить не удается (см. рис. 28.9). Это позволяет предполагать, что определенная область между полосами расширилась.
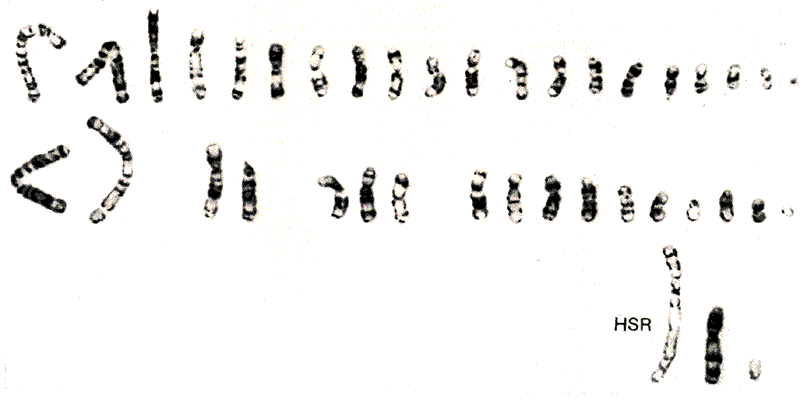
Рис. 38.10. Амплифицированные копии гена dhfr образуют гомогенно окрашивающуюся область (HSR) в хромосоме.
В тех хромосомах нестабильных клеточных линий, которые несут ген dhfr, изменений не обнаружено. Однако в этом случае установлено появление большого числа элементов, названных двойными микрохромосомами. Такие хромосомы видны на рис. 38.11. В типичной клеточной линии каждая двойная микрохромосома несет 2-4 гена dhfr. Двойные микрохромосомы, по-видимому, представляют собой самореплицирующиеся структуры, утратившие центромеры. В результате они не способны прикрепляться к митотическому веретену, сегрегируют нерегулярно и поэтому часто утрачиваются дочерними клетками. Несмотря на данное им название, в действительности двойные микрохромосомы представляют собой внехромосомные элементы.
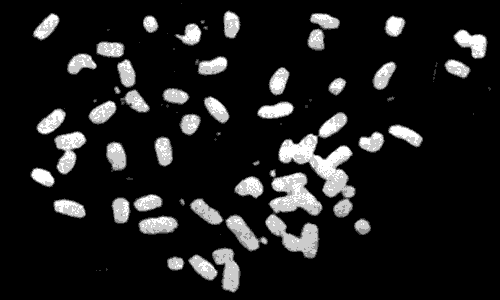
Рис. 38.11. Амплифицированные внехромосомные гены dhfr приобретают форму двойных микрохромосом, которые видны в виде мелких белых точек. Фотография любезно предоставлена Р. Шимке.
Нерегулярное наследование двойных микрохромосом объясняет нестабильность признака резистентности к метотрексату в этих линиях. Двойные микрохромосомы непрерывно утрачиваются во время клеточных делений; в присутствии же метотрексата клетки с уменьшенным числом генов dhfr погибают. В популяции выживших клеток сохраняются только те клетки, которые сохранили достаточное количество двойных микрохромосом. Присутствие этих структур уменьшает скорость деления клеток. В результате при снятии селективного давления клетки, утратившие амплифицированные гены, имеют селективное преимущество: они быстрее образуют потомство и вскоре оказываются в популяции в большинстве. Именно этим можно объяснить, почему амплифицированное состояние сохраняется, только пока клетки растут в присутствии метотрексата.
Продолжительная селекция на устойчивость к метотрексату позволила выделить как стабильные, так и нестабильные по этому признаку линии клеток. Какова первоначальная ступень в амплификации гена? На первых ступенях отбора большинство или все резистентные клетки проявляют нестабильность. Образование внехромосомных копий явно представляет собой более частое событие, чем амплификация внутри хромосомы. Мы не знаем, происходит ли внутрихромосомная амплификация менее часто как процесс, происходящий de novo, или она связана с внехромосомной амплификацией, являющейся промежуточной ступенью процесса. Из-за неправильной сегрегации двойных микрохромосом увеличение числа копий может происходить относительно быстро в тех случаях, когда при каждом делении отбираются клетки, содержащие больше, чем положено, копий генов dhfr. Такие клетки возникают и отбираются в ответ на возросшие уровни метотрексата. Поведение двойных микрохромосом объясняет ступенчатую эволюцию признака mtxr и нерегулярные колебания в уровне генов в нестабильных линиях.
Каким образом возникают внехромосомные копии? Мы знаем, что их образование не связано с утратой исходной копии хромосомы. Одна из возможностей представлена на рис. 38.12. Показано, что вблизи генов dhfr инициируются дополнительные циклы репликации. Благодаря какому-то рекомбинационному событию из хромосомы высвобождаются внехромосомные копии. В зависимости от природы такого события может образовываться внехромосомная молекула ДНК, содержащая одну или несколько копий. Если двойные микрохромосомы содержат кольцевые ДНК, рекомбинация между ними в любом случае будет приводить к образованию мультимерных молекул.
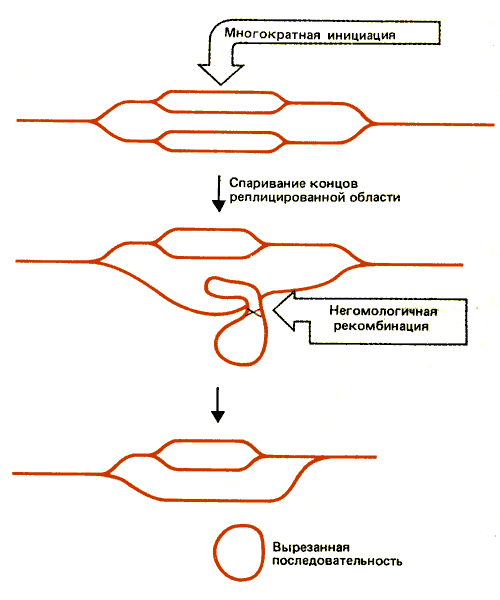
Рис. 38.12. Внехромосомные копии ДНК могли возникать путем реинициации репликации, сопровождаемой негомологичной рекомбинацией между репликами.
Происхождение амплифицированных хромосомных копий объяснить значительно сложнее. HSR состоит из большого числа тандемно повторенных единиц. Одна из трудностей в объяснении их возникновения путем интеграции последовательностей двойных микрохромосом связана с тем, что число хромосомных повторов во много раз больше, чем число повторов в отдельных двойных микрохромосомах. Большое число интегрированных копий является также препятствием при создании моделей для строго внутрихромосомного события амплификации.
Амплифицирующаяся область значительно протяженнее, чем сам ген dhfr. Ген имеет длину, равную примерно 31 т.п.н., в то время как средняя длина повторяющейся единицы составляет 5-105-1-106 пар оснований в хромосомной области HSR. Протяженность ДНК двойных микрохромосом, по-видимому, колеблется в пределах от 1•105 до 1•106 пар оснований. Хромосомная область, дающая начало амплифицированным генам, может соответствовать репликону, в котором она локализована.
Амплификация происходит и в отсутствие метотрексата, однако, если нет какого-либо селективного давления, клеточная популяция утрачивает ее продукты. Почему такое явление характерно лишь для нескольких генов? Возможно, амплификация затрагивает гены, расположенные в соответствующих участках репликона, или происходит в тех случаях, когда в этих участках находятся соответствующие повторяющиеся последовательности, позволяющие этой области выщепляться с помощью рекомбинации.
Некоторая информация о событиях, вовлекаемых в процесс сохранения двойных микрохромосом, получена благодаря изучению нестабильных клеточных линий, в которых амплифицированные гены кодируют мутантный фермент DHFR. Мутантный фермент не присутствует в исходной (диплоидной) линии клеток; следовательно, мутация должна была возникнуть в какой-то момент процесса амплификации. Несмотря на вариации в числе амплифицированных генов, эти клетки обладают только мутантным ферментом. Следовательно, хромосомные гены дикого типа не могут служить постоянным источником больших количеств новых двойных микрохромосом, так как их амплифицированные копии образовывали бы нормальный фермент.
Следовательно, изменения в состоянии клетки осуществляются благодаря однажды возникшим амплифицированным внехромосомным генам, а не благодаря исходным хромосомным копиям этих генов. При удалении метотрексата клеточная линия утрачивает свои двойные микрохромосомы. При повторной обработке реагентом нормальные гены амплифицируются, давая новую популяцию двойных микрохромосом. Следовательно, ни одна из внехромосомных копий мутантного гена не встраивается в хромосому. Другой важный вывод, следующий из этих результатов, сводится к тому, что двойные микрохромосомы мутантной линии несут только мутантные гены, так что в случае наличия в двойных микрохромосомах более одного гена dhfr все они должны быть мутантного типа. Это показывает, что мультикопийные двойные микрохромосомы могут образовываться из отдельных внехромосомных генов.
Эксперименты с трансфекцией были начаты с добавления препаратов метафазных хромосом к суспензиям клеток. Хромосомы включались клетками довольно неэффективно, и с низкой частотой возникали нестабильные варианты. Интактные хромосомы редко сохранялись во время процедуры; реципиентные клетки обычно приобретали фрагмент донорной хромосомы (который отличался нестабильностью из-за отсутствия центромеры). В редких случаях возникали стабильные линии в результате интеграции материала донора с хромосомой хозяина.
Такие же результаты получены при добавлении к реципиентным клеткам очищенной ДНК. В этом случае оказалось возможным добавлять определенные последовательности, а не полагаться на случайную фрагментацию хромосом. В результате трансфекции с помощью ДНК получают как стабильные, так и нестабильные линии. Эти эксперименты аналогичны бактериальной трансформации, однако их называют трансфекцией, поскольку исторически термин «трансформация» используют при описании изменений, позволяющих эукариотическим клеткам неограниченно размножаться.
Низкая частота трансфекции делает необходимым использование донорных маркеров, присутствие которых в реципиентных клетках способствует отбору. Следует отметить, что трансфицированные последовательности экспрессируются. В большинстве экспериментов по трансфекции использовали маркеры, связанные с легко определяемыми ферментативными функциями, но в принципе может быть использован любой селектируемый маркер. Это позволяет выделить гены, ответственные за морфологические изменения. Например, могут быть отобраны трансфицированные клетки, которые приобрели трансформированный фенотип (способность неограниченно размножаться с образованием опухоли). Затем можно идентифицировать последовательность ДНК, ответственную за изменение фенотипа. Таким способом были выделены некоторые клеточные onc-гены.
Котрансфекция двух и более маркеров дала дополнительные сведения о механизме трансфекции и расширила круг вопросов, которые могут быть решены с помощью этого метода. В случае трансфекции клеток tk- препаратами ДНК, содержащими очищенный ген tk+ и геном фХ174, все трансформанты содержат обе донорные последовательности. Это наблюдение оказалось полезным, поскольку позволило вводить неселективные маркеры посредством котрансфекции с селектируемым маркером.
Расположение последовательностей tk и фХ174 различно в каждой трансфицированной линии, но во время размножения одной линии оно сохраняется неизменным. Часто обнаруживается множество копий донорных последовательностей, причем число их в отдельных линиях варьирует. Ревертанты утрачивают последовательности фХ174 вместе с последовательностями tk. Амплификация трансфицированных последовательностей в условиях селективного давления ведет к равному и одновременному увеличению числа копий всех донорных последовательностей. Следовательно, два типа донорных последовательностей оказываются во время трансфекции связанными физически и имеют общую судьбу.
В опытах по трансфекции массу добавленной к реципиентным клеткам ДНК обычно увеличивают за счет избытка ДНК-носителя, препарата какой-то другой ДНК (например, ДНК спермы лосося). Доказано, что трансфицируемые клетки получают ДНК-носитель в виде последовательностей, фланкирующих селектируемые с каждой стороны. Следовательно, трансфекция осуществляется структурой ДНК, состоящей из ряда сцепленных последовательностей всех типов, присутствующих в препарате донора. Поскольку ревертанты по селектируемому маркеру утрачивают весь этот материал, кажется вероятным, что трансфицируемые клетки приобретают только одну такую структуру ДНК. Данная структурная единица может образовываться благодаря конкатемерному сцеплению донорных последовательностей в ходе реакции, которая проходит очень быстро по сравнению с другими событиями, вовлекаемыми в процесс трансфекции. Такая трансфицируемая единица может иметь протяженность около 1•106 п.н. Мы не можем установить с помощью метода гибридизации, сцеплена ли донорная единица с хромосомной ДНК реципиента (интересующие нас концевые фрагменты представлены в слишком незначительных количествах). Вероятно, что первая стадия процесса заключается в образования нестабильных внехромосомных единиц, которые впоследствии стабилизируются в результате интеграции. В некоторых клеточных линиях методом гибридизации in situ было показано, что трансфицированные клетки содержат донорный материал, интегрированный в хромосомы хозяина. Любая определенная клеточная линия имеет только один сайт интеграции; однако сайты в каждой линии различны. Вероятно, выбор сайта для интеграции - случайное событие; иногда оно связано с большими хромосомными перестройками.
Некоторые интересные результаты, полученные при котрансфекции двух селективных маркеров, суммированы на рис. 38.13. Линия реципиентных клеток APRT- ТК- была трансфицирована с помощью ДНК, несущей гены aprt и tk. Ген aprt был представлен активным аллелем aprt+, кодирующим фермент аденозинфосфорибо-зилтрансферазу. Ген tk представлял неактивный аллель, сохраняющий кодирующую область фермента тимидин-киназы, но утративший промотор. Трансфицированные клетки отбирали, используя маркер aprt+, однако при этом приобретались обе донорные последовательности. Затем клетки APRT+ TK- подвергали селекции по способности обеспечивать функцию TK+. Осуществление этой функции зависело от двух событий. ТК должен был транскрибироваться с какого-то сайта, замещающего его промотор; поскольку это обусловливает только низкий уровень экспрессии, необходимо увеличение числа копий данного гена, т.е. его амплификация.
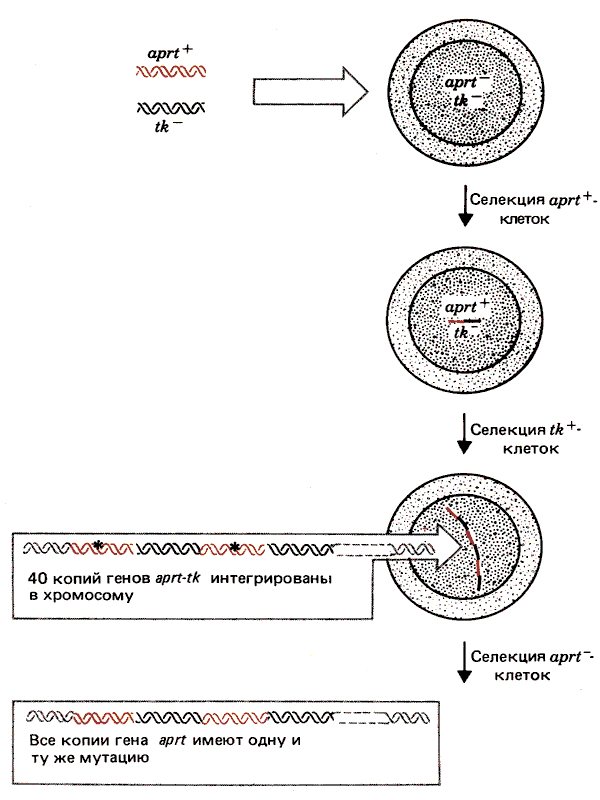
Рис. 38.13. В случае амплификации трансфицированных генов весь кластер координированно реагирует на дальнейшее селективное давление.
Отобранные клетки имели фенотип APRT+ TK+ и содержали около 40 копий трансфицируемых единиц aprt-tk, интегрированных в один хромосомный сайт. Наконец, среди этих клеток отбирали клетки с фенотипом APRT-. Их появление связано с элиминацией экспрессии копий гена aprt+ без повреждения экспрессии гена tk. Интересно, что все копии гена aprt в этих клетках приобретали одну и ту же негативную мутацию. Этот результат свидетельствует о существовании какого-то механизма, который позволяет всей группе генов быть регенерированной из одного гена или подвергаться коррекции в соответствии с последовательностью одного гена; по-видимому, это происходит в течение одной клеточной генерации.
Метод трансфекции успешно применяется для введения генов в геном животных (рис. 38.14). Плазмиды, несущие интересующий исследователей ген, вводятся в зародышевый пузырек (ядро) ооцита мыши или в пронуклеус оплодотворенного яйца. Затем это яйцо имплантируется самке. Таким образом, были введены гены глобина и гибридные гены, содержащие промотор для металлотионеина, который сцеплен с кодирующей последовательностью тимидинкиназы. Промотор МТ ведет происхождение от природного гена мыши; его присутствие можно определить по способности отвечать на обычную индукцию тяжелыми металлами или глюкокортикоидами (ответ определяют по активности тимидинкиназы).
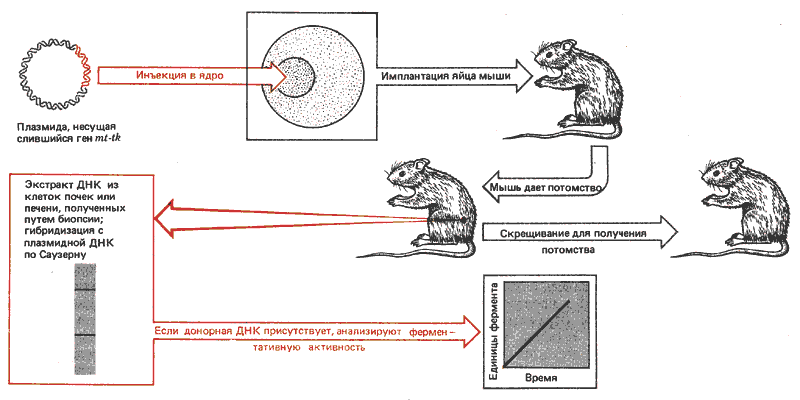
Рис. 38.14. С помощью трансфекции можно вводить ДНК в клетки зародышевых линий животных.
В этих опытах ДНК плазмид ввели в 69 яиц. Десять из развившихся мышей несли инъецированную последовательность, что было показано при анализе ДНК из клеток почек. Обычно в один хромосомный сайт множество копий плазмид внедрялось, по-видимому, тандемно. Число копий варьировало от 1 до 150. Они наследовались потомством инъецированной мыши, подобно тому как происходит наследование менделевского локуса. У семи мышей в почках и печени происходила экспрессия гена тимидинкиназы (ткани, в которых обычно ген МТ проявляет активность). Выражения не наблюдали в клетках мозга, ткани, в которой обычно ген не функционирует. Экспрессия индуцировалась при добавлении тяжелых металлов, но не глюкокортикоидов.
В потомстве инъецированной мыши экспрессия донорного гена варьировала. Уровень экспрессии гена не коррелировал с числом тандемно интегрированных копий даже у исходных родителей. Возможно, только некоторые из генов были активными. (Следует указать, что если бы были активными все дополнительные гены, вряд ли сохранялся бы нормальный регуляторный ответ, поскольку большое число промоторов способно связать большинство регуляторных молекул.)
Чем вызваны вариации в экспрессии генов? Одно из объяснений, часто используемое для случаев трансфицированных генов и интегрированных геномов ретровирусов, связано с предполагаемой важной ролью сайта интеграции. Возможно, что ген выражается, если он интегрирован только в пределах активного домена. Другая возможность заключается в наличии эпигенетической модификации. Некоторые из трансфицированных генов мышей оказались метилированными. (Так как донорная ДНК не несла метальные группы, это наблюдение позволяет предположить, что существует фермент, способный осуществлять метилирование de novo.) Изменения в способе метилирования генов могут обусловливать изменение их активности. С другой стороны, гены, которые являются активными у родителей, могут быть делетированными или амплифицированными у потомства.
На примере этих экспериментов мы видим возможность расширения круга объектов для исследования регуляции от культивируемых клеток до животных. Возможность введения ДНК в геном позвоночных, позволяет нам производить в нем изменения, добавлять новые гены, способные нести определенные модификации, введенные в ДНК in vitro. С помощью этого метода может оказаться возможным выявить причины тканеспецифичной экспрессии генов. Вероятно, в конце концов станет реальностью и замена дефектных генов в генотипе.
Природа ретровирусов подробно проанализирована в сб. "Mobile Genetic Elements" (ed. Shapiro, Academic Press, New York, 1983). Сведения о геноме D. melanogaster приводятся в обзоре Спрадлинга и Рубина (Spradling, Rubin, Ann. Rev. Genet., 15, 219-264, 1981); эффекты, связанные с мутацией ocelliless, описываются в работе Спрадлинга и др. (Spradling et al, Cell, 27, 193-202 и 203-210, 1981). События, вовлекаемые в амплификацию гена dhfr, рассматривает Шимке (Schimke et al, Cold Spring Harbor Symp. Quant. Biol, 45, 785-797, 1981). Возможности трансфекции анализирует Пеллицер (Pellicer et al, Science, 209, 1414-1422, 1980). О методике инъекции генов мышей в клетки сообщает Полмитер (Palmiter et al., Cell, 29, 701-710, 1982).