

NATURE | VOL 415 | pp. 848-849 | 21 FEBRUARY 2002 | Эволюционная биология
Как насекомые потеряли конечности.
Майк Левин
Членистоногие являются самыми успешными животными на Земли как с точки зрения разнообразия форм, так и их абсолютного числа. Они включают четыре замечательные группы: трилобитов (увы, вымерших), насекомых, ракообразных (креветка, омар, краб и т.д.) и хелицеровых (мечехвосты, пауки и скорпионы). Успех эволюционной ветви членистоногих определяется, в частности, их модульной архитектурой. Их тела состоят из серии повторяющихся сегментов, которые могут модифицироваться, по-видимому, неограниченным образом. Некоторые сегменты несут крылья, тогда как другие - антенны, ноги, органы питания или специализированные устройства для спаривания.
К этому списку можно добавить то обстоятельство, что об эволюционных процессах, ответственных за многообразие членистоногих, мы знаем больше, чем для любой другой группы животных. Это стало возможным благодаря детальному анализу генетических механизмов, лежащих в основе развития одного, самым тщательным образом охарактеризованного из всех животных - насекомого, плодовой мушки Drosophila melanogaster. После почти столетия генетического анализа, были определены многие из генов, ответственные за сегментацию и развитие конечностей. И самые главные среди них - это класс регуляторных генов, Hox генов, которые кодируют ДНК-связывающиеся белки и управляют ранним развитием. В течение последних десяти лет эта информация отпочковалась в новую область ''эволюция и развитие'' (‘’evo-devo’’), которая лежит в точке пересечения эволюционной биологии и эмбриологии и её предметом является, в частности, определение того, как возникло разнообразие конечностей у разных членистоногих,
Детей учат, что у насекомых шесть ног, по две в каждом из трех грудных (средних) сегментов, и что это относится к каждому из более чем миллиона видов насекомых. В противоположность этому, другие членистоногие, например, ракообразные, имеют разное число конечностей для плавания. Некоторые ракообразное имеют конечности на каждом из сегментов груди и брюшка. Статьи на страницах 910 и 914 этого издания, Galant и Carroll [1], и Ronshaugen et al. [2], содержат новые данные о том, как насекомые потеряли брюшные конечности, и почему у них только шесть ног.
Эти две группы [1,2] приводят доказательства того, что подавление развития брюшных конечностей насекомых зависит от функциональных изменений в белке называющимся Ultrabithorax (Ubx), который кодируется одним из Hox генов. В переднем отделе брюшка эмбриона дрозофилы белок Ubx подавляет экспрессию другого гена, Distalless (Dll), который необходим для образования конечностей. Тем не менее, у ракообразных, как например, морской креветки артемии, во всех развивающихся конечностях поддерживается высокий уровень экспрессии Ubx белка.
Здесь можно сделать и другое сравнение - с бархатными червями. Это представители онихофоровых*) - близких родственников членистоногих, которые имеют конечности во всех сегментах. У бархатных червей, белок Ubx экспрессируется по крайней мере в некоторых из этих конечностях. Таким образом, экспрессия Ubx совместима с развитием конечностей у ракообразных и у онихофоровых, но не совмещается с развитием конечностей у дрозофилы (и других насекомых).
Новая работа включала аномальную экспрессию Ubx белка дрозофилы в презумптивной грудной клетке трансгенного эмбриона дрозофилы. Развитие конечностей подавлялось из-за репрессии Dll. В противоположность этому, аномальная экспрессия Ubx белков онихофоровых и ракообразных не влияла на экспрессию Dll и на образование грудных конечностей. Эти результаты заставили предположить, что Ubx белок дрозофилы функционально отличается от Ubx белков онихофоровых и ракообразных. В одной из работ было высказано предположение, что Ubx белок дрозофилы приобрел богатый аланином пептид, который связывает репрессию транскрипции гена; этот пептид отсутствует у онихофоровых [1]. В другой работе [2] представлены доказательства того, что Ubx белок ракообразного содержит дополнительный пептид, который модулирует активность аланин-богатого пептида, и, возможно, другие области репрессия в Ubx белке ракообразного.
Удаление этого регуляторного пептида у Ubx белка ракообразного вызывает подавление экспрессии Dll в эмбрионе мухи. И наоборот, модифицируя Ubx белок плодовой мушки так, чтобы включить регуляторный пептид, отменяет его репрессорную активность. Этот пептид содержит места потенциального фосфорилирования казеин-киназой (CKII), таким образом, Ubx белок ракообразного может функционировать как условный репрессор: он может подавить экспрессию Hox гена Antennapedia (Antp) в грудных областях не изменяя экспрессии Dll в тех же тканях. Во время дивергенции ракообразных и насекомых, Ubx, вероятно, эволюционировал в следующем направлении: предназначенный для - конститутивный - репрессор развития конечностей у насекомых.
Схема эволюции функции Ubx белка показана на Рисунке 1. Ubx белок онихофоровых мог функционировать как активатор развития конечностей. Когда онихофоровые и членистоногие дивергировали, Ubx белок приобрёл аланин-богатый репрессорный домен около своего карбоксильного конца. У насекомых этот домен осуществляет конститутивную репрессию. Но у ракообразных дополнительный регуляторный пептид переключает его на функционирование условном режиме. В результате, Ubx белок не подавляет развитие конечностей у ракообразных. Но у насекомых он подавляет развитие брюшных конечностей, существенно уменьшая общее количество конечностей по сравнению с ракообразными.
Рис. 1. Эволюция через изменения в функции Hox белка. Так выглядит интерпретация новых результатов [1,2].
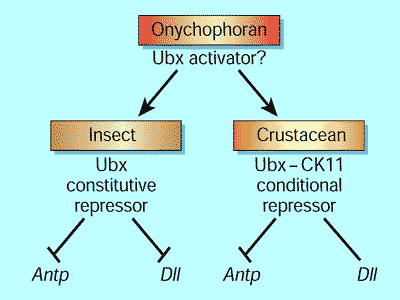
Онихофоровые, как например, бархатные черви, - близкие родственники членистоногих, имеют конечности на каждом сегменте. У них Ubx белок мог функционировать как активатор, но когда онихофоровые и членистоногие дивергировали, он приобрел один или более репрессорных доменов, которые подавляли развитие конечностей. У насекомых эти домены связывают конститутивную репрессию генов-мишеней, как например, Antp и Dll. В течение последующей дивергенции ракообразные - насекомые, Ubx белок ракообразных приобрёл регуляторный пептид, содержащий потенциальные CKII места фосфорилирования, превращающий Ubx белок в условный репрессор. Например, у морской креветки артемии, Ubx белок репрессирует ген Antp, не влияя на экспрессию гена Dll. Альтернативная точка зрения состоит в том, что белок онихофоровых содержит как репрессорный домен, так и регуляторный пептид, и этот пептид потерян у насекомых, но сохраняется у ракообразных.
Работы Galant и Carroll [1] и Ronshaugen et al. [2], - замечательная демонстрация важности белковой эволюции в создании разнообразия конечностей членистоногих. Анализ [2] Ubx белка ракообразного устанавливает особенно строгий стандарт для будущих ‘’evo-devo’’ исследований, в этой работе авторы идентифицировали точные замены аминокислот, которые ответственны за подавление развития конечностей насекомых.
Тем не менее, есть другие стороны в этой истории. Например, изменения в экспрессии гена, а не изменения в белковой функции, были ответственны за превращение плавательных конечностей в питательные конечности у определенного видов ракообразных [3,4] (Рис. 2). В этом примере, сдвиг в паттерне экспрессии Ubx белка сопровождался изменением экспрессии другого Hox гена, Sex combs reduced (Scr).
Рисунок 2. Эволюция через изменения экспрессии Hox генов.
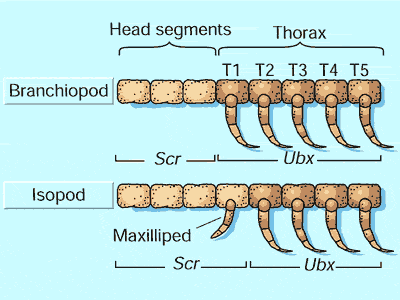
У ракообразных, известных как жаброногие (Branchiopods) (верх), голова содержит питающие конечности, тогда как ближайший к голове грудной сегмент T1 содержит плавательные конечности, похожие на расположенные дальше на грудной клетке (сегменты T2-T5). У этих животных экспрессия одного из Hox генов (Scr) ограничивается головными сегментами, а ген Ubx экспрессируется во всех грудных сегментах. У других ракообразных, как например, равноногих **) (низ), первые грудные сигменты модифицировались в структуры для питания, называемые максиллопедами (ногочелюстями). Это изменение коррелирует с изменением паттернов экспрессии Hox генов: экспрессия Ubx заменяется на экспрессию Scr в первом грудной сегменте.
Другой пример исходит из эволюционного преобразования задних крыльев в рудиментарные крылья (жужжальца) в группе насекомых, двукрылых, включающих и дрозофилу [5,6]. В центре этого процесса лежат ''цис-регуляторные последовательности'', которые располагаются в областях ДНК, примыкающих к гену, и которые влияют на его экспрессию. У дрозофилы образование жужжалец, возможно, зависело от постепенного приобретения мест связывания для Ubx белка в цис-регуляторных областях ДНК других ''генов роста'', как например, wingless и decapentaplegic. Как уже обсуждалось выше, Ubx белок у насекомых функционирует как локальный репрессор. Хотя он экспессируется в задних крыльях бабочек, он не подавляет их рост, возможно из-за того, что в цис-регуляторных участках ДНК генов роста бабочки нет мест связывания для Ubx-белка [5,6].
Рисунок 3. Эволюция через изменения в генах-мишенях Hox белка.
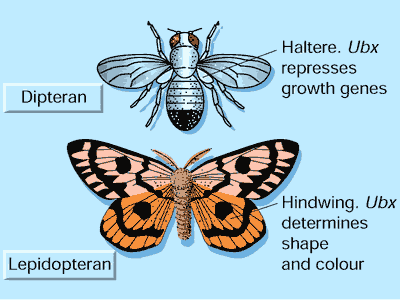
Среди насекомых двукрылые (как например, дрозофила, верх) вместо задней пары крыльев имеют рудиментарные крылья, назваемые жужжальцами. Ubx белок репрессирует рост в жужжальцах, подавляя развитие крыльев. В противоположность этому, у чешуекрылых (как например, мотылек, низ) имеются хорошо развитые задние крылья. Ubx не репрессирует рост у чешуекрылых задних крыльев, и было предположено, что связанные с этими генами цис-регуляторные последовательности потеряли места связывания для Ubx репрессора. У бабочек, Ubx прежде всего регулирует гены, которые определяют характеристики задних и передних крыльев, например, определяющие форму и цвет.
Суммируя, ''evo-devo'' исследования дают подтверждение для трех отдельных механизмов эволюция конечностей у членистоногих. Первый - изменения в паттернах экспрессии Hox генов (Рис. 2). Второй - данный Hox белок может регулировать разные гены-мишени у разных насекомых, благодаря эволюции мест связывания Hox белков в цис-регуляторных областях ДНК генов-мишеней (Рис. 3). Третий - как показано в новых работах [1,2], в Hox белках могут развиваться новые активности (Рис. 1). Мы в очередной раз убеждаемся, что эволюция - оппортунистична и использует каждую опечатку в тексте для того, чтобы произвести "бесконечные формы, самые красивые и самые замечательные" [7].
Mike Levine is in the Department of Molecular and Cellular Biology, Division of Genetics, 401 Barker Hall, University of California, Berkeley, California 94720, USA. e-mail: [email protected]
1. Galant, R. & Carroll, S. B. Nature 415, 910-913 (2002); online 6 February 2002 (10.1038/nature717).
2. Ronshaugen, M., McGinnis, N. & McGinnis, W. Nature 415, 914-917 (2002); online 6 February 2002 (10.1038/nature716).
3. Averof, M. & Patel, N. H. Nature 388, 682-686 (1997).
4. Abzhanov, A. & Kaufman, T. C. Development 126, 1121-1128 (1999).
5. Weatherbee, S. D., Halder, G., Kim, J., Hudson, A. & Carroll, S. B. Genes Dev. 12, 1474-1482 (1998).
6. Weatherbee, S. D. et al. Curr. Biol. 9, 109-115 (1999).
7. Darwin, C. On the Origin of Species (John Murray, London, 1859).
*) Онихофоровые (Onychophora), первичнотрахейные (Protrachtfta), тип беспозвоночных. Тело сегментированное (от 13 до 43 сегментов), гусеницеобразное, дл. до 15 см, покрыто тонкой хитиновой кутикулой (отличается составом хитина от кутикулы членистоногих). На каждом сегменте пара примитивных ножек с хитиновыми коготками. Голова неясно обособлена, несёт рот, пару длинных антенн (у основания которых пара глаз), хитиновые челюсти и 2 ротовых сосочка с отверстиями слизистых желёз. Полость тела смешанная (миксоцель). Головной мозг из 3 отделов, связан с 2 брюшными нервными стволами. Органы дыхания - слабо развитые пучки трахей. Кровеносная система незамкнутая. Пищеварительная система в виде трубки вдоль тела. Органы выделения - парные целомодукты, открываются у основания ног. Раздельнополые. Почти все живородящие. 1 класс - Onychophora, или Protracheata; 70 видов. Обитают в лесной подстилке тропич. и умеренной зон Юж. полушария. Хищники (ловят добычу с помощью клейкой слизи, выделяемой ротовыми сосчками). Прежде О. рассматривали как переходные формы между кольчатыми червями и трахейнодышащими, ныне их считают независимой ветвью, отделившейся от кольчатых червей. (Биол. энц. словарь, М.,1986).
**) Равноногие (Isopoda), отряд высших раков. Известны с триаса, остатки хорошо сохранились в олигоценовых отложениях. Длина обычно от 1 до 5 см, глубоководного Bathynomus giganteus - до 37 см. Тело у большинства уплощено в спинно-брюшном направлении. С головой срастаются 1, реже 2 грудных сегмента. Карапакса нет. Глаза сидячие, у подземных и глубоководных Р. отсутствуют. Грудные конечности одноветвистые, ходильные, часто на 1-3 парах ложные клешни. Брюшко короче груди, число его сегментов обычно сокращено, часть из них или все срастаются с тельсоном, образуя плеотельсон. Брюшные ноги двуветвистые, листовидные, расположены под плеотельсоном, передние преобразованы в жабры. Ок. 4500 видов; морские (от зоны заплеска до предельных океанических глубин), пресноводные (в поверхностных и подземных водах) и наземные формы. Плотоядные, растительноядные, всеядные и грунтоеды; некоторые морские виды используют в пищу древесину (сверлящие Р. рода Limnoria); есть паразиты рыб, др. какообразных. Яйца развиваются в выводковой камере на груди самки. Широко известны мокрицы, водяной ослик, морской таракан и др. (Биол. энц. словарь, М.,1986).
NATURE | VOL 415 | 6 February 2002 |
Мутация белка Нох и макроэволюция строения тела насекомых.
Мэтью Роншауген, Надин Макгиннис и Уильям Макгиннис.
Секция Клеточной Биологии и Биологии Развития, Университет Калифорнии — Сан Diego, Ла Jolla, Калифорния 92093, США.
Один из самых интригующих вопросов биологии – каким образом молекулярные изменения во время эволюции приводят к макроэволюционным изменениям в морфологии. Мутации в гомеозисных (Нох) генах уже давно предлагали считать возможными причинами морфологической эволюции [1,2]. Имеются многочисленные подтверждения того, что некоторые изменения в характере экспрессии Нох генов коррелирует с изменениями осевого плана строения тела животных [3]. Главный морфологический переход у многоклеточных произошел примерно 400 млн лет назад, когда произошла дивергенция шестиногие насекомые от похожих на ракообразных членистоногих предков с их многочисленными конечностями [4–7]. У Drosophila melanogaster и у других насекомых Hox-белки Ultrabithorax (Ubx) и abdominal А (AbdA, или abd-A) экспрессируются в основном в брюшных сегментах, где они могут подавлять развитие ножек во время эмбриогенеза [3]. У ракообразных бранхиопод белки Ubx/AbdA экспрессируются как в грудных, так и в брюшных сегментах, включая зачатки конечностей, но не подавляют развитие конечностей [8-11]. Предыдущие исследования позволили нам предположить, что приобретение и потеря транскрипционной активации и функций репрессии Нох белками были весьма вероятным механизмом превнесения морфологического разнообразия во время эволюции животных [12]. Здесь мы показываем, что вызванные естественном отбором изменения в Ubx белке связаны с эволюционным переходом к животным, имеющим шесть ног.
Аверов и Акам [8] предположили, что эволюция от ракообразных предков к шестиногим происходила в две фазы. В первой фазе мутации привели к тому, что экспрессия Ubx/AbdA протекала только прото-брюшной области (рис 1а), во второй фазе мутации на пути к эксприссии Ubx/AbdA привели к подавлению роста конечностей грудного типа в прото-брюшке. Мутации в этой второй, подавляющей рост конечностей фазе, могли произойти либо в последовательностях, кодирующих Ubx/AbdA белки, либо в регуляторных участках или в участках, кодирующих последовательности генов, экспессирующихся вслед за Ubx/AbdA, либо в регуляторных или кодирующих последовательности для Нох-кофакторов, либо комбинацией этих событий.
В эмбрионах Drosophila melanogaster эктопическая экспрессия Ubx белка в грудной области почти полностью подавляет развитие конечностей, таким образом, кофакторы, необходимые для подавления роста конечностей, присутствуют как в брюшной, так и в грудной областях [13,14]. Эта эктопическая экспрессия может быть использована для того, чтобы проверить, может ли Ubx белок ракообразных или других членистоногих подавлять развитие конечностей, что и было недавно использовано, и показано, что Ubx белок червя онихофора (Akanthokara Kaputensis, вид родственного типа членистоногих) не подавляет развитие конечностей у зародыша дрозофилы [15]. Так как есть доказательства того, что плеченогие ракообразные и шестиногие насекомые - это родственные группы [7], мы выбрали для проверки функции подавления развития конечностей у эмбрионов дрозофилы Ubx белок ракообразного Artemia franciscana.
Мы сравнили последовательность Ubx белка артемии с последовательностями Ubx белков дрозофилы, шестиногого москита (Anopheles Gambiae) и онихофоры (A. kaputensis) (Рис. 1b; см. Приложение). Как видно из рисунка, Ubx белок дрозофилы имеет большие блоки последовательностей аминокислот, отсутствующих в Ubx белке артемии, и наоборот (рис. 1b). В области связывающегося с ДНК гомеодомена, Ubx белок артемии имеет идентичную последовательность с двумя другими Ubx белками членистоногих, кроме единственной замены аланина на серин (рис. 1b). Все последовательности аминокислот Ubx белков членистогого и червя имеют шесть блоков гомологии (показанно синим цветом), но между двумя шестиногими в последовательностях Ubx белков имеются также шесть дополнительных блоков гомологии (показано желтым).
Рисунок 1. Эволюция признаков, вызванных экспрессией главных Нох генов, и сравнение последовательностей Ubx белков членистоногих.
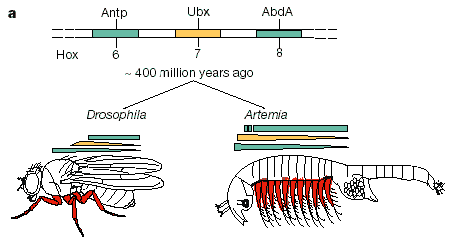
а. Ветвь ракообразных (например, Artemia franciscana) отделилась от ветви насекомых (например, Drosophila melanogaster) около 400 миллионов лет назад. Ракообразные сохранили многочисленные конечности (на рисунке показаны красным цветом), тогда как число конечностей насекомого сократились до трёх грудных пар. К этому периоду эволюции членистоногих их главные Hox гены (Antp, Ubx и Abd-A) уже подверглись дупликации и дивергенции [23].

b. Соотнесение аминокислотных последовательностей Ubx белков плодовой мухи дрозофилы (DmUbx), москита Anopheles gambiae (AgUbx), морской креветки Artemia franciscana (AfUbx) и бархатного червя Akanthokara kaputensis (AkUbx). Последовательности мотивов, в разной степени общие для всех Ubx гомологов, показаны синим цветом; гомологичные мотивы, общие только между шестиногими дрозофилой и комаром, показаны желтым. Точки перекрёста двух приведённых на рис. 3 гибридных белков (Dros281Art и Art250Dros), отмечены стрелками.
Сначала мы проверили трансгенные линии дрозофилы, которые эктопически продуцировали гибридные Ubx белки артемии или дрозофилы, содержавшие или не содержавшие введенный в их карбоксильные концы антиген гаммоглютенина (HA). HA эпитоп использовался для того, чтобы показать в каких клетках и в каких количествах эти белки продуцируются, и отличать их экспрессию от экспрессии эндогенного Ubx. Мы не нашли заметных различий между фенотипами, индуцировавшимися содержащими HA-маркёр Ubx белками дрозофилы или артемии, и фенотипами, индуцировавшимися белками диких типов, и не нашли разницы между белками ни дрозофила, ни артемии, ни их вариантами, индуцировавшимися эктопическими транскриптами эндогенных Ubx или AbdA генов (данные не приведены).
Рис. 2. Сравнение влияния эктопических Ubx белков Artemia franciscana (Af ) и Ubx белков Drosophila melanogaster (Dm) на морфологию дрозофилы и Ubx гены-мишени.
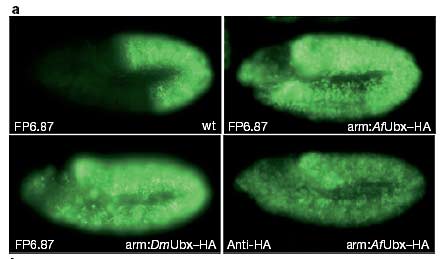
а. Две левых фотографий показывают уровени DmUbx белков, детектированный с помощью моноклональных антител FP6.87 (ссылка 24). Верхняя левая фотография показывает уровень DmUbx белка дикого типа, определенный в его обычной зоне нижней части грудной клетки и передней части брюшка. Нижняя левая фотография показывает, что при использовании GAL4 вектора с DmUbx-HA в условиях, описанных в разделе Методы, в грудной клетке и сегментах головы вырабатываются одинаковые уровни белков UAS-DmUbx-HA. Верхняя правая фотография показывает эмбрион (с Ubx-HA) в котором белок Af Ubx-HA экспрессируется в грудной клетке на уровне, эквивалентном DmUbx-HA. На нижней правой фотографии AfUbx эмбрион, коотрый индуцировался при тех же условиях, что и показанный на верхнем правом снимке, был окрашен анти-НА моноклональными антителами.
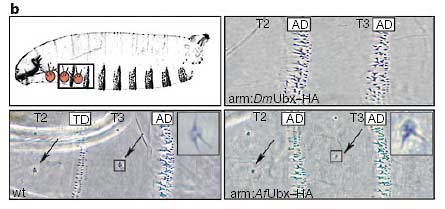
b. Вверху слева - рисунок личинки дрозофилы ранней возрастной стадии с показанным красным цветом положением грудных конечностей (органы Кейлина, КО). В кутикулах дикого типа (wt) развиваются грудные КО (стрелки), то же самое происходит и в кутикулах из эмбрионов, в которых AfUbx-HA белок эктопически экспрессировался на уровнях, показанном в рис.2а. Эмбрионы с DmUbx-HA не образуют грудных КО в грудных сигментах (arm-DmUbx-HA). Белки AfUbx-НА и DmUbx-HA сходны друг с другом (AfUbx-НА немного слабее) в способности ускорять развитие гомеозисных фенотипов, таких как трансформация грудных зубчатых поясков (TD) в сторону их брюшной идентичности (AD), так же как и подавление образования Т1 - бородки и нарушения усложнения головы (данные не показаны).
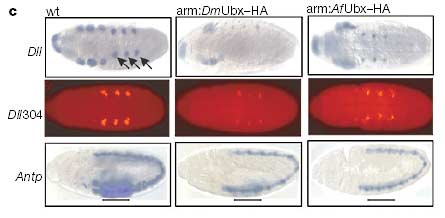
с. Верхний ряд: паттерны Dll-транскриптов в эмбрионах дикого типа и в эмбрионах, эктопически экспрессирующих либо AfUbx, либо DmUbx под контролем GAL4 вектора. Стрелками указаны парные пятна транскриптов Dll, маркирующих зачатки грудных конечностей в эмбрионах дикого типа. Средний ряд: паттерны экспрессии специфичного для грудных конечностей Dll304-lacZ репортёрного гена в тех же самых трех генотипах. Нижний ряд: паттерны экспрессии Antp P1 транскриптов в тех же трех генотипах. Antp P1 транскрипты в грудном эпидермисе (подчеркнуты) сильно подавлены как эктопическим Af Ubx, так и DmUbx белками.
Когда Ubx-HA белок как дрозофилы, так и артемии экспрессируется в грудной части эмбриона (Рис. 2a) на уровнях, эквивалентных уровням экспрессии эндогенного Ubx белка в брюшной области (см. Дополнительную информациюцию), тогда эктопические белки частично трансформируют полоски грудных зубчиков в полоски, похожие на брюшные (Рис. 2b). Белки дрозофилы и артемии были также сходны в подавлении развития первой грудной (Т1) зубчатой “бородки”, в подавлении образование нормальных головных структур и в ускорении развития брюшных зубчиков в головных сегментах (не показано). Ubx-HA белок дрозофилы производил более сильные версии этих фенотипов, чем Ubx-HA белок артемии. Тем не менее очевидно, что продуцированный в эмбрионах мухи Ubx белок артемии функционален и способен эктопически вызывать некоторые формы брюшной идентичности, по образу, сходному с Ubx белком дрозофилы.
Ubx гомологи этих двух видов показали разительные отличия в их способности подавлять развитие грудных конечностей эмбрионов (органы Кейлина): Ubx-HA дрозофилы полностью подавлял развитие конечностей, тогда как Ubx-HA артемии – только на 15% (рис. 2b и 3). Distal-less (Dll – вызывающий отсутствие конечностей) – важный конечностеобразующий ген у большинства или у всех членистоногих [10], и транскрипция Dll дрозофилы непосредственно подавляется связыванием Ubx белка с вышерасположенным энхансером, называемым Dll304 (ссылка 16). Как и ожидалось, белок Ubx-HA дрозофилы сильно подавлял Dll транскрипты и репортёрные Dll304 транскрипты в эмбриональных зачатках конечностей, однако Ubx-HA белок артемии оказывал только умеренное влияние на уровни экспрессии транскриптов Dll и репортёрного Dll304 (рис. 2c). Неспособность белка артемии к существенному подавлению Dll - это не результат отсутствия общей репрессорной функции, поскольку эмбриональные транскрипты с промотора Antennapedia (Antp) P1 полностью подавлялись белками Ubx-HA артемии, аналогично белкам Ubx-HA дрозофилы (Рис. 2c).
Суммируя: полномасштабный Ubx белок артемии обеспечивает “обрюшинивающую” функцию у эмбрионального эпидермиса дрозофилы, но имеет слабый репрессивный эффект на развитие грудных конечностей эмбриона дрозофилы. Далее: конечностеподавляющая разница между Ubx белками артемии и дрозофилы по крайней мере частично связана с их различными способностями к транскрипционному подавлению гена Dll. Хотя мы указываем на различия между этими двумя белками как на различия в функции подавления развития конечностей, мы не имеем в виду, что эта функция подавления является единственной функцией, управляющей генами развития конечностей.
Чтобы картировать в Ubx белке конечностеподавляющий домен (домены), которым дрозофила несомненно обладает, а артемия – нет, мы сконструировали серию гибридных и мутантных белков (рис.3). Гибридный Ubx белок, состоящий из 356 N-концевых аминокислот дрозофилы и только из 29 С-концевых аминокислотных остатков артемии почти полностью (уровень ~ 20%) потерял способность репрессировать развитие конечностей. И наоборот, когда 29 С-концевых аминокислотных остатков дрозофилы заменили С-концевыми остатками Ubx артемии (Art250Dros, рис. 3), гибридный белок приобрел (на уровне 70%) способность репрессировать развитие конечностей. Одно из объяснений этих результатов состоит в том, что Ubx белок дрозофилы имеет подавляющий развитие конечностей домен в своем С-конце, состоящий из 26 аминокислот, тогда как С-концевые последовательности артемии не достаточны для подавления развития конечностей. Другое объяснение этих результатов состоит в том, что С-концевые последовательности артемии могут регулировать (тормозить) конечностеподавляющий домен, который присутствует где-либо как в Ubx белке артемии, так и в белке дрозофилы. Присутствие такой функции, по-видимому, согласуется с предыдущими исследованиями, указывавшими, что С-конец Ubx белка дрозофилы может быть удален без, или с небольшим влиянием, на его эмбриональную ''конечностоноподавляющую'' функцию [14,17].
Для того, чтобы сделать выбор из этих возможных вариантов, мы провели испытание мутантного Ubx-HA белка, в котором С-конец был удален. Этот мутантный белок сильно подавлял развитие конечностей (на 80%, рис.3). Мы также провели испытание варианта Ubx белка дрозофилы и варианта Art250Dros гибрида, в котором отмеченный блок консервативной последовательности, состоящей из глутаминов и аланинов (QA- мотив, рис.4) был удален. Обе конструкции с удаленным QA мотивом сохранили потенциальные эмбрионные ''конечностеподавляющие'' функции (Рис.3). Это показывает, что С-конец, и конкретно QA- мотив, не требуется для проявления полных репрессорных активностей Ubx белка дрозофилы или Ubx гибридных белков дрозофила-артемия, и что эти 29 С-концевых аминокислот Ubx белка артемии ингибируют проявление домена подавления развития конечностей, находящегося где-то в другом месте этого белка.
Рис.3. Подавление развития грудных конечностей гибридными белками артемия/дрозофила.
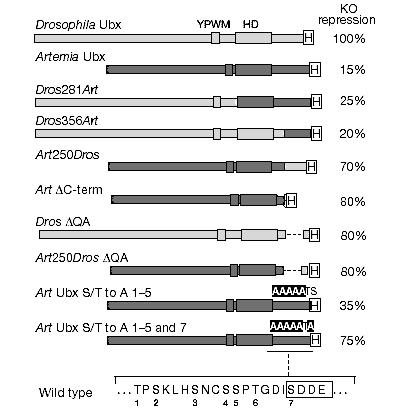
Слева - диаграммы белков, испытанных в пробах, где измерялась репрессия развития конечностей. Символы над белками указывают относительное количество аминокислот в последовательности Ubx от дрозофилы (Dros) или от Артемии (Art). Например, Art250Dros озачает, что первые 250 аминокислот белка Ubx артемии, замещают соответствующую область Ubx белка дрозофилы. В Art-^C-term 29 С-концевых аминокислот белка Ubx артемии были удалены (Соответствующую аминокислотную последовательность см. на Рис.1 или на Рис.4). В Dros ^QA и Art 250Dros ^QA были удалены все 16 аминокислот мотива QA (выделены на рис.4). Дизайн конструкций от Ubx S/T к A состоял в комбинации замен определённых остатков аланина в семи С-концевых остатках серина и треонина артемии. Эти остатки пронумерованы под С-концевой последовательностью артемии дикого типа. Колонка непосредственно справа от белков (КО repression) показывает процент подавления развития грудных конечностей личинки (органы Кейлина, n = 300; округлено до ближайшего 5%-го значения). Это подавление измерялось у животных, когда концентрации в грудных сигментах брюшных эктопически экспрессированных белков были скорректированы до уровня, который менее чем на 30% отличался от тех, что наблюдались для Ubx дикого типа в брюшных клетках (см. Рис.2а и Дополнительную информацию). HD - гомеодомен, H - гемаглютининовая метка.
В наших исследованиях 45 С-концевых аминокислот Ubx белка дрозофилы играли в значительной степени факультатиную роль в химирных белках артемия/дрозофила и были неспособны ингибировать подавляющий развитие конечностей домен, который находится где-то в другом месте в Ubx белках дрозофилы и артемии. Тем не менее, некоторая функция положительной репрессии может кодироваться в сильно консервативном QA-мотиве, поскольку подавление органов Кейлина снижается примерно на 20%, когда этот мотив удален. Это согласуется с результатами, приведёнными в сопроводительной работе [18], которые показывают, что эти последовательности, которые включают C-концевой QA домен Ubx белка дрозофилы достаточны для того, чтобы обеспечить функцию подавления конечностей у эмбрионов гибридным белком онихофора/дрозофила, и также достаточны для того, чтобы обеспечить функцию подавления транскрипции в пересеваемых образцах культур тканей.
Поскольку С-концевые области Ubx белков ракообразных могут оказывать тормозящий эффект на функцию подавления конечностей белков плодовой мухи или морской креветки, мы проверили С-концевые последовательности Ubx белков различных насекомых или других членистоногих на наличие потенциально информативных консервативных аминокислотных остатков (О названиях видов и каталожных номерах см. Дополнительную информацию). Видно, что все известные или предполагаемые Ubx белки, которые не проявляют функции подавления роста конечностей, имеют в своих С-концевых доменах много остатков серина или треонина, входящих в состав консервативных сайтов фосфорилирования (Рис.4). В Ubx белке артемии, большинство С-концевых серинов входит в консенсусную часть сайта фосфорилирования казеиновой киназы II (CKII), после фосфорилирования эти серины образуют добавочные консенсусные сайты для фосфорилирования как CKII, так и для GSK-3 [19] (рис.4). Ни один из Ubx белков насекомых не имеет остатков серина или треонина в своих С-концевых доменах (рис.4).
Эта корреляция представляет большой потенциальный интерес, поскольку было показано, что остатки серина и треонина в Antp Hox белках могут модулировать его функцию в эмбрионах [20]. Замещение серина или треонина аланином в 4-х консенсусных сайтах Antp (включая два, показанных на рис. 4) привели к тому, что Нох белки показали сильную репрессию развития конечностей и подавление транскрипции Dll [20]. Один из этих CKII сайтов, расположенный чуть позади гомеодомена высоко консервативен в Antp-подобных белках млекопитающих [21]. Это, в комбинации с изложенными здесь результатами, предполагает, что неспособность Ubx белков артемии и других членистоногих с многочисленными конечностями подавлять развитие конечностей могла заключаться в присутствии серино-треониновых сайтов фосфорилирования, что ингибирует проявление скрытого домена подавления конечностей в Ubx белках членистоногих.
Рис. 4. Эволюция Ubx и Antp белковой последовательности у насекомых и других членистоногих.
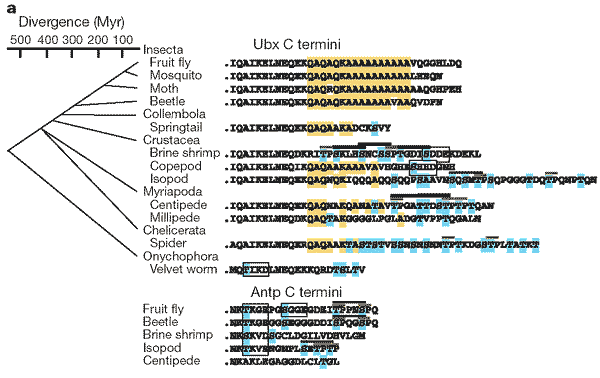
а, Сравнение С-концевых последовательностей Ubx и Antp. Последовательности С конца Ubx белков от различных видов насекомых и других членистоногих выровнены к правой стороне сверху. Эта область дрозофилы включает QA-мотив из 16 аминокислот (QAQAQKAAAAAAAAAA). Соответствия этой последовательности в Ubx последовательностях других членистоногих показаны желтым цветом. Филогенетическое дерево слева показывает порядок ветвления других таксонов от дрозофилы и примерное время дивергенции от настоящего (Myr- миллионов лет назад). Внизу показаны Antp С-концы из двух насекомых и из трех других видов членистоногих. Параллепипедами выделены CKII-консенсусные последовательности сайтов фосфорилирования для Antp и Ubx гомологов. Черной чертой отмечены консенсусные сайты для GSK-3-фосфорилирования; красной чертой отмечены S/TP мотивы, которые являются потенциальными местами узнавания для МАР фосфорилизирующей киназы. Голубым цветом закрашены остатки серина и треонина в этих или в других местах возможного фосфорилирования на С-концах Antp и Ubx членистоногих. Соответствующую нумерацию показанных на рисунке последовательностей можно найти в Дополнительной информации.

b. Модель предполагаемых функциональных изменений в Ubx белке в родословных линиях насекомых и ракообразных бранхиопод. Мутации в предшествующих формах Ubx белка у предка ракообразных и насекомых удалили серин-треониновые сайты фосфорилирования и тем самым торможение конечносте-подавляющей функции, находившейся в N-концевых последовательностях предкового Ubx. Эта тормозящая функция, механизм которой неизвестен, осталась существовать до сегодняшнего дня в Ubx ракообразных бранхиопод. Эти мутации, когда они были поддержаны расширением QA-богатого домена на С-конце, генерировали насекомоотличительную версию Ubx, которая имела конечносте-подавляющие функции, внесшую свой вклад в построение тела шестиногих.
Чтобы это проверить, мы создали версии мутантных Ubx белков артемии, в которых С-концевые остатки серина и треонина были изменены на аланин. В первом таком мутанте (Art Ubx S/T to A 1–5), первые пять остатков в С-концах были заменены на аланин. Этот мутантный Ubx проявлял слабую функцию подавления развития конечностей, сходную с Ubx белком артемии дикого типа (рис.3). Тем не менее, мутация одного дополнительного серина в CKII консенсусном сайте (Art Ubx S/T от A 1–5 и 7) в Ubx привела к сильному подавлению развития конечностей эмбрионов (Рис.3).
На основании этих результатов мы предположили, что Ubx белки у некоторых предков ракообразных и насекомых разблокировали функцию подавления развития конечностей мутацией в С-концевых серино-треониновых сайтах фосфорилирования. Вместе с ограничением экспрессии Ubx в задней часть туловища, и с расширением QA-богатого домена, потеря этих мест фосфорилирования, по-видимому, внесла свой вклад в эволюцию строения тела шестиногих. Предполагаемая, проходящая через стадию фосфорилирования, регуляция функции подавления транскрипции в Ubx белках членистоногих может иметь механизм, подобный недавно описанному для Even-skipped белка дрозофилы [22]. В обоих случаях такой механизм может обеспечивать посредничество путем сигнальной трансдукции контроля функциями активации транскрипции или репрессии гомеозисных генов.
Насколько мы знаем, эти результаты – первые экспериментальные данные, связывающие вызванные естественным отбором изменения в специфической последовательности белка с главным морфологическим переходом в эволюции. Имеются по крайней мере две основные причины, почему мутации в кластере(?) серино-треониновых остатков, ингибирующих функцию репрессии, могло быть предпочтительным в эволюционном аспекте. Первое: мутирование этих остатков могло дать доминантные фенотипы, устраняющие необходимость для фиксации двух рецессивных мутаций в линии эволюции морфологии. Второе: последующее удаление серино-треониновых остатков могло количественно усилить репрессорную функцию и морфологию, допуская жизнеспособные микроэволюционные шаги в направлении к “подающим надежды монстрам”[1] с макроэволюционными изменениями формы тела.
Методы.
Модельные конструкции эктопической экспрессии.
Полные конструкции генов, экспрессирующих Ubx белок и гибридные Ubx белки были сделаны с помощью полимеразной цепной реакции (ПЦР) из ДНК, полученной копированием матричной РНК обратной транскриптазой. ПЦР использовалась для введения на 5’-конец места инициации трансляции, близкого к оптимальному консенсусу. ПЦР использовалась также для введения кодонов геммоглютининового антигена на 3’-конце Ubx белка с сохранением открытой рамки считывания. [Последовательности, кодирующие] гибридные белки дрозофила/артемия были сделаны с первоначальной амплификацией кодирующих фрагментов Ubx белков дрозофилы и артемии с праймерами, содержавшими перекрывающиеся последовательности. Полные последовательности химер конструировались последующей амплификацией полученных фрагментов с праймерами, содержащими 5’- и 3'-концевые перекрывания. Полученные фрагменты с тупыми концами клонировались в Gal4-индуцируемый вектор pUAST. Эти конструкции вводились в w1118 эмбрионы и многочисленные трансгенные линии были отобраны и тестированы на эктопическую экспрессию и функционирование, как это описано в тексте.
Генетика, эмбриональные кутикулы и генная экспрессия.
Другие линии дрозофилы были получены от Bloomington Stock Center. Они включали: UAS–Ubx1a, arm–GAL4, and arm–GAL4; Dll304–lacZ. Самцы мух, нёсших конструкции UAS–Ubx, спаривались с вагинальными самками мух, гомозиготных по arm–GAL4 во второй или третьей хромосоме. Эмбрионы отбирались примерно через 12 часов и выращивались в течение более чем 24 часов перед препарированием отобранных кутикул. Для того, чтобы установить эквивалентные уровни экспрессии Ubx и Ubx-гибридных белков, мы меняли трансформированую линию, тип arm–GAL4 носителя и температуру (25оС или 29оC) (См. также Сопроводительные материалы).
Окрашивание антителами и гибридизация in situ
Все прокрашивания антителами были проведены на эмбрионах возрастом 3-9 часов, которые были dechorionated (?) и фиксированы 20-ти минутной обработкой в 4%-ном формальдегиде. Информацию о методах и антителах, использовавшиеся для детектирования НА-эпитопа, Ubx и бета-галоктозидазы, а также о методах и пробах для проведения in situ гибридизации можно найти в Приложениях к данной статье.
1. Goldschmidt, R. The Material Basis of Evolution (Yale Univ. Press, New Haven, Connecticut, 1940).
2. Lewis, E. B. A gene complex controlling segmentation in Drosophila. Nature 276, 565-570 (1978).
3. Carroll, S. B., Grenier, J. K. & Weatherbee, S. D. From DNA to Diversity (Blackwell Science, London, 2001).
4. Boore, J. L., Collins, T. M., Stanton, D., Daehler, L. L. & Brown, W. M. Deducing the pattern of arthropod phylogeny from mitochondrial DNA rearrangements. Nature 376, 163-165 (1995).
5. Friedrich, M. & Tautz, D. Ribosomal DNA phylogeny of the major extant arthropod classes and the evolution of myriapods. Nature 376, 165-167 (1995).
6. Aguinaldo, A. et al. Evidence for a clade of nematodes, arthropods and other moulting animals. Nature 387, 489-493 (1997).
7. Regier, J. C. & Shultz, J.W.Molecular phylogeny of the major arthropod groups indicates polyphyly of crustaceans and a new hypothesis for the origin of hexapods. Mol. Biol. Evol. 14, 902-913 (1997).
8. Averof,M. & Akam, M. Hox genes and the diversification of insect and crustacean body plans. Nature 376, 420-423 (1995).
9. Averof, M. & Patel, N. Crustacean appendage evolution associated with changes in Hox gene expression. Nature 388, 682-686 (1997).
10. Panganiban, G., Sebring, A., Nagy, L. & Carroll, S. The development of crustacean limbs and the evolution of arthropods. Science 270, 1363-1366 (1995).
11. Abzhanov, A. & Kaufman, T. C. Crustacean (malacostracan) Hox genes and the evolution of the arthropod trunk. Development 127, 2239-2249 (2000).
12. Li, X. & McGinnis, W. Activity regulation of Hox proteins, a mechanism for altering functional specificity in development and evolution. Proc. Natl Acad. Sci. USA 96, 6802-6807 (1999).
13. Gonzalez-Reyes, A. & Morata, G. The developmental effect of overexpressing a Ubx product in Drosophila embryos is dependent on its interactions with other homeotic products. Cell 61, 515-522 (1990).
14. Mann, R. S. & Hogness, D. S. Functional dissection of Ultrabithorax protein in D. melanogaster. Cell 60, 597-610 (1990).
15. Grenier, J. K. & Carroll, S. B. Functional evolution of the Ultrabithorax protein. Proc. Natl Acad. Sci. USA 97, 704-709 (2000).
16. Vachon, G. et al. Homeotic genes of the bithorax complex repress limb development in the abdomen of the Drosophila embryo through the target gene Distal-less. Cell 71, 437-450 (1992).
17. Chan, S. & Mann, R. S. The segment identity functions of Ultrabithorax are contained within its homeo domain and carboxy-terminal sequences. Genes Dev. 7, 796-811 (1993).
18. Galant, R. & Carroll, S. B. Evolution of a transcriptional repression domain in an insect Hox protein. Nature advance online publication, 6 February 2002 (DOI 10.1038/nature717).
19. Fiol, C. J., Mahrenholz, A. M., Wang, Y., Boeske, R. W. & Roach, P. J. Formation of protein kinase recognition sites by covalent modification of the substrate. J. Biol. Chem. 262, 14042-14048 (1987).
20. JAffe, L., Ryoo, H. & Mann, R. S. A role for phosphorylation by casein kinase II in modulating Antennapedia activity in Drosophila. Genes Dev. 11, 1327-1340 (1997).
21. Fienberg, A. A. et al. Phylogenetically conserved CK-II phosphorylation site of the murine homeodomain protein Hoxb-6. J. Exp. Zool. 285, 76-84 (1999).
22. Li, C. & Manley, J. L. Allosteric regulation of Even-skipped repression activity by phosphorylation. Mol. Cell 3, 77-86 (2000).
23. Grenier, J. K., Garber, T. L., Warren, R., Whitington, P. M. & Carroll, S. Evolution of the entire arthropod Hox gene set predated the origin and radiation of the onychophoran/arthropod clade. Curr. Biol. 7, 547-553 (1997).
24. Kelsh, R. R. O. J.W.,White, R. A. H. & Akam, M. Homeotic gene expression in the locust Schistocerca: An antibody that detects conserved epitopes in ultrabithorax and abdominal-A proteins. Dev. Genet. 15, 19-31 (1994).
Supplementary Information accompanies the paper on Nature’s website (http://www.nature.com).
================================
Figure 2 Comparison of the effects of ectopic Artemia franciscana (Af ) Ubx and Drosophila melanogaster (Dm) Ubx proteins on Drosophila morphology and Ubx target genes. a, The two leftmost panels show DmUbx protein levels detected with the monoclonal antibody FP6.87 (ref. 24). The top left panel shows wild-type (wt) DmUbx detected in its normal domain of the posterior thorax and anterior abdomen. The lower left panel shows that equal levels of UAS–DmUbx–HA protein are produced in the thorax and portions of the head using an arm–GAL4 driver (arm:DmUbx–HA) under conditions described in the Methods. The upper right panel shows an embryo (arm:Af Ubx–HA) in which Af Ubx–HA protein is expressed in the thorax at levels equivalent to DmUbx–HA. In the lower right panel, an Af Ubx–HA embryo induced under the same conditions as in theupper right panel is stained with anti-HA monoclonal antibodies. b, Top left, a drawing of aDrosophila first-instar larva, with the positions of the thoracic limbs (Keilin’s organs, KO)shown in red. Wild-type cuticles (wt) develop thoracic KO (arrows), as do cuticles fromembryos in which Af Ubx–HA protein is ectopically expressed at the levels shown in a. Embryos with DmUbx–HA in the thorax (arm:DmUbx–HA) do not develop thoracic KO. Af Ubx–HA and DmUbx–HA are similar (with Af Ubx–HA slightly weaker) in their capacity to promote homeotic phenotypes such as transformation of thoracic denticle belts (TD) towards abdominal identity (AD), as well as suppression of T1 beard formation and disruption of head involution (not shown). c, Top row, the pattern of Dll transcripts in wildtype embryos and in embryos ectopically expressing either Af Ubx or DmUbx under the control of an arm–GAL4 driver. The paired patches of Dll transcript marking the thoracic limb primordia in wild-type embryos are marked with arrows. Middle row, the expression pattern of the thoracic-limb-specific Dll304–lacZ reporter gene in the same three genotypes. Bottom row, the expression pattern of Antp P1 transcripts in the same three genotypes. Antp P1 transcripts in the thoracic epidermis (bar) are strongly repressed by both ectopic Af Ubx and DmUbx proteins.
Figure 3 Repression of thoracic limbs by Artemia/Drosophila Ubx hybrid proteins. On the left are diagrams of the proteins tested in limb-repression assays. The symbols above the proteins denote the relative amounts of Drosophila (Dros) or Artemia (Art ) Ubx amino-acid sequence. For example, Art 250Dros has the first 250 amino acids of Artemia Ubx substituted for the comparable region in Drosophila Ubx. In Art DC-term, the 29 C-terminal amino acids of Artemia Ubx were deleted (see Fig. 1 or 4 for sequence). In Dros DQA and Art 250DrosDQA, the 16 amino acids of the QA motif (highlighted in Fig. 4) were precisely deleted. The Art Ubx S/T to A constructs contain combinations of precise alanine substitutions in the seven Artemia C-terminal serine and threonine residues. These residues are numbered beneath the wild-type Artemia C-terminal sequence. The column immediately to the right of the proteins (KO repression) shows the percentage of larval thoracic limbs repressed (Keilin’s organs, n = 300; rounded to the nearest 5%). This was measured in animals when the ventral thoracic concentrations of the ectopically expressed proteins were adjusted to a level that was less than 30% different to that observed for wild-type Ubx in ventral abdominal cells (see Fig. 2a and Supplementary Information). HD, homeodomain; H, haemagglutinin tag
To test this, we generated mutant versions of Artemia Ubx in which C-terminal Ser/Thr residues were mutated to Ala. In the first such mutant (Art Ubx S/T to A 1–5), the first five Ser and Thr residues in the C-terminus are changed to Ala. This mutant Ubx has little limb-repression function, similar to wild-type Artemia Ubx (Fig. 3). However, the mutation of one additional Ser in a CKII consensus site (Art Ubx S/T to A 1–5 and 7) results in a Ubx that strongly represses embryonic limbs (Fig. 3).
On the basis of these results, we propose that Ubx proteins in some crustacean/insect ancestors uncovered a limb-repression function by the mutation of C-terminal Ser/Thr phosphorylation sites. Together with the restriction of Ubx expression to the posterior trunk and expansion of a QA-rich domain, the loss of these sites would have contributed to the evolution of the hexapod body plan. The putative phosphorylation-mediated regulation of transcriptional repression function in arthropod Ubx proteins may occur by a similar mechanism to that recently described for the Drosophila Even-skipped protein22. In both cases, such a mechanism would provide for the mediation by signal transduction of the control of transcriptional activation and repression functions of homeobox genes.
To our knowledge, this is the first experimental evidence that links naturally selected alterations of a specific protein sequence to a major morphological transition in evolution. There are at least two major reasons why the mutation of mutiple Ser/Thr residues that inhibit a repression function might be advantageous from an evolutionary aspect. First, mutating the residues would give dominant phenotypes, eliminating the need to fix two recessive mutations in a morphologically evolving lineage. Second, the successive removal of Ser/Thr residues might quantitatively influence repression function and morphology, allowing viable microevolutionary steps toward “hopeful monsters”1 with macroevolutionary alterations in body shape. A
Figure 4 The evolution of Ubx and Antp protein sequence in insects and other arthropods.
a, Comparison of Ubx and Antp C-terminal sequences. Sequences of the C termini of Ubx proteins from a variety of insects and other arthropod species are aligned on the top right. This region includes the 16-amino-acid Drosophila QA motif (QAQAQKAAAAAAAAAA). Matches to this sequence in the Ubx sequences of other arthropods are shown in yellow. A phylogenetic tree on the left shows the branching order of the other taxa from Drosophila and the approximate divergence times before present (Myr, million years ago). At the bottom, the Antp C termini from two insects and three other arthropod species are shown. The CKII consensus phosphorylation sites are boxed in both Antp and Ubx homologues. Consensus sites for GSK-3 phosphorylation are marked with black bars; S/TP motifs that are potential sites for MAP kinase phosphorylation are marked with red bars. Ser and Thr residues in these or other potential phosphorylation sites in the arthropod Antp and Ubx C termini are shown in blue. Accession numbers for the sequences shown in this figure can be found in the Supplementary Information.
b, Model of the proposed functional change in Ubx protein in the insect and branchiopod crustacean lineages. Mutations in an ancestral form of Ubx in a crustacean/insect progenitor removed Ser/Thr phosphorylation sites and thus the inhibition of a limbrepression function located in N-terminal sequences of ancestral Ubx. This inhibitory function, of unknown mechanism, still exists in present-day branchiopod crustacean Ubx. These mutations, when assisted with an expansion of a QA-rich domain in the C terminus, generated an insect version of Ubx which had limb-repression functions that contributed to the hexapod body plan.
Methods
Ectopic expression constructs Full-length Ubx and Ubx-hybrid expression constructs were made by polymerase chain reaction (PCR) from full-length cDNAs derived from reverse transcription. PCR was used to incorporate a near-optimal translation-initiation consensus at the 5 0 end. PCR was also used to incorporate codons for the haemagglutinin antigen at the 3 0 end of the Ubx open reading frame. Drosophila/Artemia hybrid proteins were made by first amplifying coding fragments of Drosophila and Artemia Ubx with overlapping sequences incorporated into primers. Full-length chimaeras were then constructed by amplifying with primers that incorporated the 5 0 and 3 0 modifications previously described. These were blunt-end cloned into the Gal4-inducible vector pUAST. These constructs were injected into w1118 embryos and multiple transgenic lines were established and tested for ectopic expression and function as described in the text. Genetics, embryonic cuticles and gene expression Other Drosophila lines were obtained from the Bloomington Stock Center. These include: UAS–Ubx1a, arm–GAL4, and arm–GAL4; Dll304–lacZ. Male flies carrying the UAS–Ubx constructs were mated in cages to virgin female flies homozygous for arm–GAL4 on the second or third chromosome. Embryos were collected for about 12 h and aged for more than 24 h before the preparation of cleared cuticles. To establish equivalent amounts of expression of Ubx and Ubx-hybrid proteins, we varied the transformed line, the type of arm–GAL4 driver, and the temperature (25 or 29 8C) (also see Supplementary Information). Antiserum staining and in situ hybridization All antibody stains were performed on 3–9-hour-old embryos that were dechorionated and fixed for 20 min in 4%formaldehyde. The methods and antibodies used to detect HA, Ubx and b-galactosidase, as well as methods and probes for in situ hybridization can be found in the Supplementary Information.
Received 26 October 2001; accepted 2 January 2002.
Acknowledgements
We thank P. Hau, S. Romanowsky, D. DeRoma and E. Tour for help with the experiments, advice, and comments on the manuscript. The Bloomington Stock Center efficiently provided numerous fly stocks. We thank J. Moore for providing a culture of Folsomia candida and R. Burton for providing a culture of Tigriopus californicus. We also thank R. Galant and S. Carroll for communicating results before publication. This work was supported by a research grant from the National Institute of Child Health/Human Development to W.M.
Competing interests statement
The authors declare that they have no competing financial interests.
Correspondence and requests for materials should be addressed to W.M. (e-mail: [email protected])
Supplementary information for Ronshaugen, McGinnis, & McGinnis, “Hox protein mutation and macroevolution of the insect body plan. Nature M10588
Cloning arthropod Hox genes. Full length Artemia franciscana Ubx and Antp protein coding sequence was obtained from mRNA extracted from Artemia nauplii collected 5 days after hatching. A fragment of the Artemia Ubx and Antp homeodomain was obtained using primers and cycling conditions similar to Pendleton et al.1 except in primers, where inosine was replaced with a fourfold degenerate site, and in the thermo-cycle, where the annealing temperature was 400C. These homeodomain fragments were used to design primers for 3’ and 5’ RACE (rapid amplification of cDNA ends) using the Marathon cDNA amplification system (Clontech). Primers were constructed in the 5’ and 3’ UTR of the RACE products and used to amplify full-length cDNA’s from multiple independent poly-T primed reverse transcriptase (RT) reactions. The final protein sequences were derived from a consensus sequence obtained from the assembly of RACE products derived from multiple independent RT reactions and verified against genomic sequence. Arthropod Ubx C-terminal sequences shown in Figure 4 were obtained in a similar manner.
Antibody stainings and in situ hybridizations. Epitope-tagged Hox genes were incubated with either a rat monoclonal antibody (Roche) directed against the hemagglutinin antigen (anti-HA) at a 1:50 dilution, or the monoclonal antibody FP6.87 2 directed against either Ubx or AbdA at a 1:3 dilution. Beta-galactosidase protein from reporter genes was detected with rabbit polyclonal antiserum at 1:100 (Cappel Research Products). Detection of anti-HA and beta-galactosidase was accomplished with the following fluorescent secondary antibodies; Cy3 conjugated donkey anti-rabbit (Jackson Labs); Cy3 conjugated donkey anti-rat (Jackson Labs), fluorescein conjugated rabbit anti-rat (Vector Labs), fluorescein conjugated donkey anti-mouse (Jackson Labs). Visualization of FP6.872 was accomplished with a biotinylated goat anti-mouse secondary (Jackson Labs), Vectastin elite ABC kit and detected with the TSA florescein system (NEN). In situ hybridizations to detect transcripts were performed using a variation of the protocol described by Tautz and Pfeifle 3. Digoxigenin-labeled antisense probes for Dll were made from a 1.2 EcoR1 cDNA fragment 4 and Antp P1 and P2 specific probes were made from plasmids described in Bermingham et al. 5.
Normalization of ectopic protein levels. The FP6.87 antibody was shown to have identical affinity for Drosophila and Artemia Ubx on a western blot in which equivalent amounts of in vitro translated protein was loaded (data not shown). This antibody was then used to establish the average level of endogenous Ubx in the ventral first abdominal segment for stage 11-12 embryos reared at 25 degrees. This average was determined by randomly sampling the mean luminosity in a 1 second (underexposed) image for a 50X50 pixel region in the middle of the A1 segment in appropriately staged animals. In parallel, multiple independent lines of Artemia Ubx HA and Drosophila Ubx HA were crossed to the arm-Gal4 driver and reared at 25 and 29 degrees. These embryos were assayed for expression in the ventral second thoracic segment. Specific lines of Artemia Ubx HA and Drosophila Ubx HA were chosen that had levels of ectopic protein nearest to the average determined for the wild type A1 segments. Identically treated embryos were then stained with a rat monoclonal anti-HA antibody and the mean luminosity with this antibody in the T2 segment was determined. All other transgenic lines were similarly assayed using the anti-HA antibody. These were selected based on similarity to the mean luminosity with the anti-HA antibody in Artemia Ubx HA embryos. The maximum variation in expression levels allowed was ~30% which was estimated to be less than the standard error for the average expression levels within a particular line. The level of ectopic protein detected in the second thoracic segment at stage 11-12 relative to Artemia Ubx are as follows: Drosophila Ubx ; 0.9, Dros281Art; 0.8 , Dros356Art; 0.7, Art DC-term; 0.7, Dros DQA; 0.7, Art250Dros DQA; 0.8, Artemia Ubx 5S/T to A; 0.7, Artemia Ubx 6 S/T to A; 0.7.
Accession numbers for the amino acid sequences shown in Figure 4. Fruit fly sequences are from Drosophila melanogaster (Ubx - P02834; Antp - CAA27417); mosquito Ubx, Anopheles gambiae (AAC31942); moth Ubx, Manduca sexta (AAB39544); beetle, Tribolium castaneum (Antp - AAK96031, Ubx - AAD38009), springtail Ubx, Folsomia candida (AF435789), brine shrimp, Artemia franciscana (Antp - AF435786, Ubx - AF435787), copepod Ubx, Tigriopus californicus (AF435788), isopod from Porcellio scaber (Antp - AAK13077, Ubx - AF435791), centipede, Ethmostigmus ribripes (Antp - AAB91389, Ubx - AAB91393), millipede Ubx, Archispirostreptus (AF435790), spider Ubx, Cupiennius salei (CAA07501).
Pendleton, J. W., Nagai B. K., Murtha M. T. & Ruddle F. H. Expansion of the Hox gene family and the evolution of chordates. Proceedings of the National Academy of Science. 90, 6300-6304 (1993).
2. Kelsh, R. R. O. J. W., White, R. A. H. & Akam, M. Homeotic gene expression in the locust Schistocerca: An antibody that detects conserved epitopes in ultrabithorax and abdominal-A proteins. Dev. Genet. 15, 19-31 (1994).
3. Tautz, D. & Pfeifle, C. A non-radioactive in situ hybridization method for the localization of specific RNAs in Drosophila embryos reveals translational control of the segmentation gene hunchback. Chromosoma 98, 81-85 (1989).
4. Cohen, S. M., Br?nner, G., K?ttner, F., J?rgens, G. & J?ckle, H. Distal-less encodes a homeodomain protein required for limb development in Drosophila. Nature 338, 432-434 (1989).
5. Bermingham, J. R., Martinez-Arias, A., Petitt, M. G. & Scott, M. P. Different patterns of transcription from the two Antennapedia promoters during Drosophila embryogenesis. Development 109, 553-566 (1990).
*) ЭКТОПИЯ (ectopia) - 1. Смещение какой-либо части тела в результате травмы или врожденного порока развития. 2. Расположение или появление чего-либо не на месте. - Эктопический (ectopic).
''Each of the homeobox genes contains a highly conservative sequence of 183 pairs of bases (183 bp), the so called homeobox, which codes homeodomain, a sequence of 61 aminoacids. The homeodomain is responsible for recognition of homeoproteins and their binding to DNA. At present, several hundred homeobox genes are identified in various invertebrates and vertebrates. Peculiarities of the primary sequences of the homeodomains of the proteins-products make it possible to subdivide this large gene family into subfamilies (classes).''