РНК — фермент
Долгое время считалось, что катализаторами всех реакций в живой клетке служат только белки — ферменты. Открытие того, что РНК может катализировать разрезание и сшивание самой себя, опровергает универсальность этого принципа, а также проливает свет на ранние этапы эволюции
ТОМАС Р. ЧЕК
МОЛЕКУЛЫ нуклеиновых кислот ДНК и РНК хранят в себе генетическую информацию, необходимую для существования и размножения живой клетки. Белки же выступают в роли действующего начала: молекулы белков-ферментов катализируют тысячи химических реакций, протекающих в клетке. Еще недавно такое «разделение труда» между информационными и действующими молекулами считалось одним из основополагающих принципов биохимии. Однако в последние несколько лет эта схема была пересмотрена в связи с открытием того, что РНК может выступать в качестве фермента.
Каталитическая активность РНК была открыта в 1981 — 1982 гг., когда мои коллеги и я изучали РНК из одноклеточного организма Tetrahymena thermophila, относящегося к типу простейших. К своему изумлению, мы обнаружили, что эта РНК может катализировать разрезание и сплайсинг самой себя, в результате чего из нее выщепляется небольшой фрагмент. Если забыть, что РНК не белок, РНК тетрахимены удовлетворяет классическому определению фермента. От «настоящих» ферментов она отличается только тем, что белки-ферменты катализируют реакции, протекающие между другими молекулами, в то время как эта РНК катализирует собственные метаморфозы. Поэтому для ферментоподобных молекул РНК мы предложили термин «рибозим» (от англ. RIBOnucleic enZYME). А недавно нам удалось показать, что в несколько измененной форме та же РНК может сшивать не только саму себя, но и другие молекулы РНК и, стало быть, является ферментом в полном смысле слова.
Что же следует из этого неожиданного открытия? Во-первых, теперь уже нельзя так безоговорочно, как раньше, принимать утверждение, что в клетке за каждой каталитической реакцией стоит белковый фермент. По нынешним представлениям, некоторые реакции, связанные с перестройкой молекул РНК, могут, по крайней мере частично, катализироваться РНК. Далее, известно, что в состав рибосом (клеточных органелл, на которых происходит синтез белка) входит по нескольку молекул РНК в дополнение к большому набору белков. Не исключено, что именно РНК, а не белки рибосомы ответственны за один из основных каталитических процессов в клетке — синтез белков. Открытие катализа РНК может, кроме того, иметь значение и для понимания эволюции. Так как нуклеиновые кислоты и белки взаимозависимы, долгое время считалось, что и возникнуть они должны были одновременно. Обнаружение того, что РНК служит не только носителем информации, но и ферментом, позволяет предположить, что в период зарождения жизни РНК могла существовать и функционировать без белков и без ДНК.
Почему в биологических системах столь необходимы катализаторы? Потребность в них проистекает в основном из свойств химических соединений, составляющих живой организм. Молекулы, принимающие участие в клеточных процессах, обычно относительно стабильны и без воздействия извне неохотно вступают в химические реакции. Ферменты ускоряют эти реакции, так что они осуществляются за времена, соизмеримые со временем жизни клетки. Заметим, что с такой работой белки справляются превосходно. Обычно белковый фермент ускоряет катализируемую им реакцию в 106 — 1012 раз; причем белки являются истинными катализаторами: после завершения реакции белковый фермент остается в той же форме, в какой вступил в нее.
В общем-то понятно, почему представление о том, что любой фермент является белком, прочно утвердилось в умах ученых, изучающих клетку. За десятилетия, прошедшие после того, как в 1926 г. Дж. Самнер из Корнеллского университета впервые выделил в чистом виде фермент — уреазу, участвующую в расщеплении мочевины, сотни ферментов были получены в индивидуальном виде. И во всех случаях фермент оказывался белком — цепочкой аминокислот, свернутой в пространстве определенным образом. В ходе исследований ферментов многое стало известно об их действии. Было обнаружено, что каждый фермент катализирует только одну биохимическую реакцию или группу очень сходных реакции. Такая исключительная специфичность обеспечивается пространственной укладкой аминокислотной цепи, придающей белку трехмерную структуру, необходимую для участия в данном химическом взаимодействии.
В 30 - 40-е годы активно изучалась «ферментативная» сторона жизни клетки, а изучение информационного аспекта в то время сильно отставало. Первый успех в этой области пришел в 1944 г., когда О. Эйвери и его коллегам из Рокфеллеровского института медицинских исследований удалось показать, что ДНК способна передавать генетическую информацию. Следующим большим достижением было установление структуры ДНК (это сделали в 1953 г. Дж. Уотсон и Ф. Крик). Эти и многие другие исследования привели к пониманию того, что сейчас кажется уже непреложной истиной: генетическая информация закодирована в последовательности нуклеотидов двойной спирали ДНК. Каждая цепь двухцепочечной молекулы ДНК представляет собой полимер, образованный из мономеров четырех видов, обозначаемых A, G, Т и С. Каждый мономер состоит из азотистого основания (которым может быть аденин [А], гуанин [G], тимин [Т] либо цитозин [С]), остатка сахара и фосфатной группы (все вместе называется «нуклеотид»). РНК - такой же полимер, но одноцепочечный и вместо тимина содержит урацил (U).
Кроме того, остаток сахара в нуклеотидах ДНК представлен дезоксирибозой, а в РНК - рибозой.
Вскоре после того, как стали понятны структура и значение ДНК, выяснилось, что РНК выполняет ключевые функции в передаче генетической информации от ДНК к белку. Сначала последовательность нуклеотидов ДНК копируется, что осуществляется в процессе транскрипции; в результате этого синтезируется матричная РНК (мРНК), последовательность нуклеотидов которой соответствует исходной ДНК. Матричная РНК связывается с рибосомой, где на ней, как по программе, собирается молекула белка.
Передача генетической информации - только одна из функций РНК. В состав самой рибосомы также входит несколько молекул РНК (рРНК). Другие небольшие молекулы РНК, называемые транспортными (тРНК), участвуют в присоединении в нужном порядке аминокислот к растущей цепи белка. В конце 70-х годов роль мРНК, рРНК и тРНК была уже давно известна и казалось, что у РНК не осталось больше никаких тайн. Но это лишь казалось.

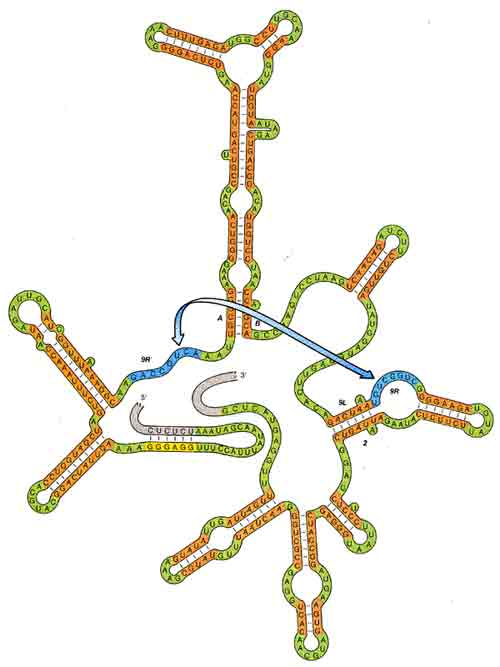
ПРОСТРАНСТВЕННАЯ СТРУКТУРА рибосомной РНК простейшего организма Tetrahymena принципиально важна для каталитической активности этой молекулы. Она поддерживается, в частности, благодаря способности одноцепочечной РНК сворачиваться, образуя короткие двухцепочечные участки. РНК— это полимер, мономерами которого являются нуклеотиды четырех видов, обозначаемых A, G, С и U. А с U, а также G с С комплементарны, т. е. образуют устойчивую пару, соединяясь водородными связями (G и U тоже могут спариваться, хотя в этом случае связь гораздо слабее). Если два фрагмента РНК содержат комплементарные последовательности нуклеотидов, то они могут соединиться и образовать двухцепочечный участок (оранжевые). Дальние взаимодействия, например между участками, обозначенными 9R и 9R' (голубые), приводят к формированию еще более сложной пространственной структуры. Эта структура способствует выщеплению из РНК тетрахимены определенного фрагмента, называемого интроном. Большая часть представленной здесь последовательности является интроном; из РНК, остающейся после выщепления интрона, показаны лишь маленькие участки, примыкающие к концам интрона (серые). Модели структуры были разработаны независимо в нескольких лабораториях, включая лабораторию автора, и результаты получились очень сходные.
В 1977 г., к удивлению всего научного мира, да и к своему собственному, две группы исследователей — Ф. Шарп с коллегами в Массачусетском технологическом институте и группа сотрудников Колд-Спринг-Харборской лаборатории — открыли, что у высших организмов гены «разорваны». Они показали, что в ДНК последовательность нуклеотидов, кодирующая белок, расположена не подряд, как полагали, а прерывается более или менее протяженными некодирующими последовательностями. Эти вставки были названы интронами, а разделенные значащие части — экзонами. Довольно скоро выяснилось, что после завершения транскрипции интроны вырезаются, аэкзо-ны последовательно соединяются («сплайсируются»), образуя непрерывную кодирующую последовательность нуклеотидов*. (* См. статьи Дж. Дарнелла-младшего «Процессинг РНК» и «РНК» («В мире науки», 1983, № 12, 1985, № 12).)
Открытие сплайсинга РНК взволновало ученых, помимо всего прочего, потому, что сплайсинг, как оказалось, характерен для эукариот, но не свойствен прокариотам, по меньшей мере хорошо изученной бактерии Escherichia соli. (К эукариотам относятся организмы, клетки которых имеют ядро, — от дрожжей до человека. Прокариоты — бактерии и некоторые водоросли — не имеют клеточного ядра.)
Появилась надежда, что изучение сплайсинга РНК прольет свет на колоссальные по сравнению с прокарио-тами эволюционные возможности эукариот, включая способность к специализации клеток и образованию многоклеточных организмов. Казалось, кроме того, вероятным, что при помощи сплайсинга РНК может регулироваться активность генов.
В конце 70-х годов регуляцию работы генов исследовали во многих лабораториях, в том числе в моей, где мы изучали гены рибосомных РНК одноклеточного эукариотического организма Tetrahymena thermophila. Чтобы понять, как работают гены pPPIK, необходимо было установить, в чем заключается и как происходит процессинг («созревание») РНК - как и в каком порядке она разрезается, сплайсируется и подвергается другим превращениям, приводящим в итоге к появлению в клетке зрелых рРНК. К 1980 г. мы уже в общих чертах представляли себе это.
Как и другие эукариоты, тетрахимена имеет четыре рибосомные РНК. Гены трех из них транскрибируются так, что образуется единая протяженная молекула РНК. Этот так называемый первичный транскрипт затем претерпевает процессинг, в результате чего образуются три разные рРНК.
Одно из первых событий, происходящее в пределах нескольких секунд после завершения транскрипции, состоит в том, что из первичного транскрипта, длина которого примерно 6400 нуклеотидов, вырезается интрон размером около 400 нуклеотидов. При этом два соседних экзона соединяются. В 1980 г. мы с А. Заугом обнаружили, что сплайсинг вполне успешно протекает «в пробирке» в реакционной смеси, содержащей экстракт из клеточных ядер. Хотя к тому времени сплайсинг был известен сравнительно давно, механизм его оставался непонятным. И мы с Заугом решили попытаться выяснить, каким образом происходит вырезание интрона у тетрахимены.
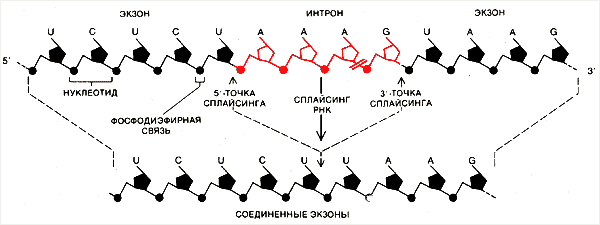
ИНТРОН УДАЛЯЕТСЯ, а соседние экзоны соединяются в функциональную молекулу РНК. Каждый нуклеотид в цепи РНК состоит из остатка 5'-углеродного сахара рибозы (пятиугольники), одного из четырех азотистых оснований — аденина (А), гуанина (G), цитозина (С) или урацила (U) — и фосфатной группы (кружки). Соседние нуклеотиды соединены фосфодиэфирной связью между 5'-углеродным атомом одного остатка сахара и 3'-углеродным атомом другого. Таким образом, цепь РНК имеет направление; ее концы обозначаются 5' и 3'. В процессе сплайсинга фосфодиэфирные связи на обоих концах интрона в точках, называемых 5'- и 3'-участками сплайсинга, разрываются и экзоны соединяются образовавшимися 3'- и 5-'-концами.
Первым делом мы постарались определить минимальный набор компонентов реакционной смеси, необходимых для сплайсинга. Для этого предшественник рРНК (несплайсированную рРНК) смешивали с различными экстрактами из ядер тетрахимены, в которых, как мы рассчитывали, должны были присутствовать гипотетические ферменты сплайсинга. В реакционную смесь добавлялись также нуклеотиды и определенные соли — из тех соображений, что в живом организме нуклеотиды, содержащие три фосфатных группы, часто служат источником энергии для различных реакций, а реакция сплайсинга, возможно, нуждается в притоке энергии извне. Действительно, оказалось, что некоторые низкомолекулярные вещества, а именно ионы магния и гуанозин либо гуаниновый нуклеотид (годятся гуанозинтрифосфат и некоторые другие), обязательны для протекания реакции. К нашему глубокому изумлению, этого нельзя было сказать о самом экстракте из клеточных ядер, предположительно содержавшем ферменты сплайсинга!
Не оставалось ничего другого, как предположить, что либо ферментативную активность проявлял белок, настолько прочно связанный с РНК, что в наших опытах его просто не удалось отделить от нее, либо сама РНК катализировала свой собственный сплайсинг. Поскольку идея о том, что все биологические катализаторы являются белками, глубоко укоренилась в науке, нам было непросто принять гипотезу о РНК-катализаторе. Вскоре, однако, мы столкнулись еще с одним случаем, наводившим на мысль о РНК в роли катализатора. П. Грабовская (делавшая тогда в моей лаборатории дипломную работу) обнаружила, что интрон тетрахимены может существовать в кольцевой форме и что линейная форма интрона может быть переведена в кольцевую, если ее инкубировать в растворе, содержащем ионы магния, без каких бы то ни было ферментов. Опыты свидетельствовали, что и эта реакция не зависит от присутствия белков и, следовательно, не нуждается ни в каких ферментах (ферментах по крайней мере в том смысле, какой вкладывали в это слово в 1981 г.).
И все же мы не могли полностью исключить возможность того, что от РНК не был отделен некий «скрытый» белковый фермент. РНК, которая использовалась в этих экспериментах, выделялась из экстракта ядер тетрахимены, т. е. из неочищенной системы, так что была некоторая вероятность, что какой-то необычайно стабильный белок при всех обработках остается прочно связанным с РНК и что он-то и катализирует выщепление и циклизацию интрона.
Чтобы Избавиться от сомнений, был проведен ряд специальных опытов, и результаты их получились вполне однозначными. Наиболее убедителен эксперимент, в котором фрагмент первичного транскрипта рРНК транскрибировался с рекомбинантной плазмиды (плазмиды — это сравнительно короткие кольцевые ДНК). Это была уже полностью искусственная система: рекомбинантную плазмиду размножали в клетках бактерии E. coli, выделяли в чистом виде и проводили ее транскрипцию при помощи очищенной бактериальной РНК-полимеразы, которую затем удаляли из раствора. Полученная таким способом РНК сама никогда не находилась в клетке или в присутствии клеточного содержимого и, следовательно, никак не могла быть «загрязнена» ферментами сплайсинга. Тем не менее она оказалась способной к сплайсингу. Более того, цепь РНК расщеплялась и соединялась в тех же самых точках, по которым сплайсинг такой РНК протекает в интактной клетке (точки сплайсинга in vivo были определены Дж. Галлом и его сотрудниками в Йельском университете).
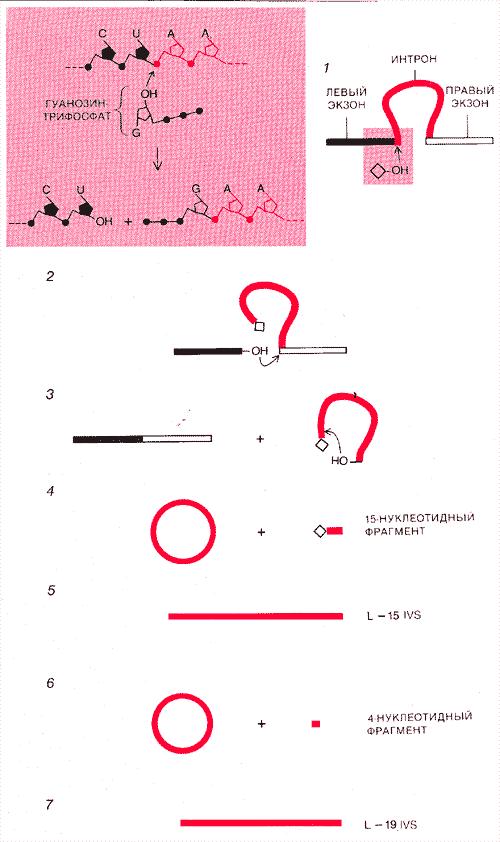
ИНТРОН УДАЛЯЕТСЯ САМ из предшественника - рибосомной РНК (рРНК) тетрахимены без участия каких бы то ни было белковых ферментов. Каскад реакций, приводящих к выщеплению интрона, инициируется молекулой гуанозина или гуанозинтрифосфата (ромбик). Гидроксильная группа (ОН) гуанозина «атакует» фосфатную группу на 5'-конце интрона (1). Фосфодиэфирная связь между интроном и левым экзоном разрывается, и образуется новая связь между гуанозином и 5'-концом интрона. В результате появляется свободный 3'-конец на левом экзоне, гидроксильная группа которого атакует 3'-конец интрона (2). Происходит разрыв этой связи, что сопровождается соединением экзонов, а интрон остается вне цепи РНК (3). Аналогичная реакция приводит к циклизации интрона с отщеплением 15 нуклеотидов от его конца (4). Кольцо размыкается, превращаясь в линейную молекулу (5), которая затем вновь образует кольцо, теряя 4 нуклеотида (6). Окончательно интрон принимает линейную форму, называемую L-19 IVS(7).
После этого не осталось никаких сомнений — у тетрахимены происходит аутосплайсинг интрона.
Нас сразу поразило, что аутосплайсинг в некоторых существенных аспектах похож на действие классических ферментов. Реакция была высокоспецифичной. Скорость ее увеличивалась на много порядков. Кроме того, если РНК помещали в раствор, препятствующий ее сворачиванию, она теряла способность к ауто-сплайсингу. Этот результат показывал, что пространственная структуpa полинуклеотиднои цепи РНК необходима для сплайсирующей активности - точно так же, как определенная пространственная структура аминокислотной цепи необходима для активности белкового фермента. Однако в отличие от «настоящих» ферментов молекула РНК катализировала только свое собственное превращение. Для того чтобы подчеркнуть это отличие, и был предложен специальный термин - рибозим.
Оказалось, что аутосплайсинг — только одна из ступеней целого каскада превращений, которые РНК тетрахимены может проделывать сама с собой. После выщепления интрон сразу переходит в кольцевую форму, открытую Грабовской. В процессе циклизации интрон, в котором изначально было 414 нуклеотидов, теряет фрагмент длиной 15 нуклеотидов. Через короткое время кольцо опять размыкается. Линейная молекула далее снова превращается в циклическую, теряя на сей раз 4 нуклеотида. Это кольцо тоже раскрывается, и образуется линейная РНК, обозначаемая L—19 IVS (от англ. linear intervening sequence — линейная интронная последовательность минус 19 нуклеотидов).
Естественно, хотелось понять, каким образом интрон катализирует все эти превращения. Некоторые указания на механизм появились еще до того, как мы поняли, что имеем дело с аутокатализом. Так, было установлено, что для реакции необходим гуанозин. Анализируя нуклеотидную последовательность выщепленного интрона, Зауг обнаружил на его конце гуанозин, не закодированный в ДНК. Логично было предположить, что гуанозин нужен в реакции сплайсинга не как источник энергии, а для присоединения к цепочке нуклеотидов интрона. Чтобы проверить это, я смешал некоторое количество радиоактивного гуанозинтрифосфата (гуанозин-трифосфат, или сокращенно GTP, представляющий собой фосфорилированный гуанозин, участвует в качестве источника энергии во многих клеточных реакциях) с немеченым несплайсированным предшественником рРНК. Действительно, GTP использовался не для энергетических целей: по завершении сплайсинга радиоактивная метка оказывалась присоединенной к концу интрона.
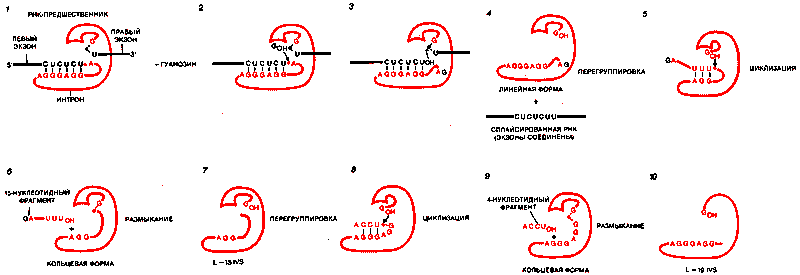
МЕХАНИЗМ АУТОКАТАЛИТИЧЕСКОГО ВЫЩЕПЛЕНИЯ интрона тетрахимены включает серию реакций переэтерификации. Нуклеотидная последовательность GGAGGG, расположенная у 5'-конца интрона, связывает последовательность CUCUCU, находящуюся на конце левого экзона {1; ингрон выделен цветом}. Одновременно активируется фосфатная группа на 5'-конце интрона (цветной ромбик}. Когда рядом имеется гуанозин, интрон связывает его таким образом, что тот может легко атаковать фосфодиэфирную связь при активированной фосфатной группе (2). После разрыва этой связи фосфатная группа на другом конце интрона, которая также активируется (черный ромбик}, подвергается атаке гидроксильной группой свободного 3'-конца левого экзона (3). В результате интрон выщепляется, а экзоны соединяются (4). Происходит перегруппировка интрона, вследствие чего последовательность UUU на его 5'-конце оказывается в положении, удобном для атаки З'-концевым гуанозином(5). Происходит циклизация интрона, причем отщепляются 15 нуклеотидов между активированным фосфатом и концом интрона (6). Кольцо размыкается (7) и вновь замыкается {8, 9), теряя 4 нуклеотида. Наконец, интрон опять переходит в линейную форму, называемую L-19IVS(70).
Какую же роль играет гуанозин в сплайсинге? Мы считаем, что GTP (или любая из нескольких других форм гуанозина) служит «атакующей группой», облегчая разрыв цепи РНК в нужном месте. Расщепление цепи РНК означает разрыв ее скелета, состоящего из чередующихся элементов двух видов — фосфатных групп и остатков пятиуглеродного сахара-рибозы (азотистые основания, различающиеся у разных нуклеотидов и собственно кодирующие генетическую информацию, соединены по одному с каждым остатком сахара). Для расщепления цепи РНК необходимо разорвать так называемую фосфодиэфирную связь, соединяющую остаток сахара с фосфатной группой. Гуанозин атакует фосфодиэфирную связь на одном из концов интрона и тем самым инициирует реакцию аутосплайсинга.
Исходя из того, что нам удалось выяснить о роли гуанозина, мы продолжили исследования с целью составить общую схему реакции аутосплайсинга. Процесс начинается с того, что молекула свободного гуанозина (или GTP), столкнувшись с интронной РНК, на какое-то время задерживается возле определенного ее участка, называемого участком связывания (как бы попадает в «карман», образованный нуклеотидной цепью интрона). В участке связывания гуанозин занимает такое положение, что его гидроксильная группа (ОН) оказывается в выгодной позиции для атаки фосфатной группы, находящейся в месте соединения экзона с 5'-концом интрона. (В молекуле нуклеиновой кислоты фосфодиэфирная связь соединяет 5'-углеродный атом одного остатка сахара через фосфат с 3'-углеродным атомом другого остатка сахара; таким образом, цепь РНК имеет направленность: один ее конец обозначается 5', другой — 3'.) В то же самое время другой участок связывания удерживает 3'-конец экзона в положении, удобном для атаки фосфодиэфирной связи гуанозином. Тонкая структура участка связывания гуанозина еще не выяснена, но участок, связывающий конец экзона, удалось идентифицировать. Им оказался фрагмент интрона с последовательностью нуклеотидов GGAGGG. Эти шесть нуклеотидов могут образовывать водородные связи с последовательностью из шести пиримидинов (CUCUCU), расположенной на 3'-конце экзона (азотистые основания нуклеотидов относятся к двум типам: А и G — это пурины, U и С — пиримидины). Удерживая одновременно шестипиримидиновую последовательность и гуанозин, интрон обеспечивает такое расположение химических группировок в пространстве, которое оптимально для их взаимодействия.
Объектом атаки гуанозина является фосфодиэфирная связь между последним нуклеотидом шестипиримидиновой последовательности (U) и следующим нуклеотидом (А). Гуанозин разрушает связь U—А, внедряясь между этими нуклеотидами и сам образуя новую связь с А. Такое «перебрасывание» фосфодиэфирной связи носит название реакции переэтерификации. При соединении гуанозина с 5'-концом интрона последний нуклеотид (U) экзона остается с ОН-группой в 3'-положении, т. е. появляется свободный 3'-конец. Однако он недолго остается свободным: моментально следует еще одна реакция переэтерификации, в результате которой соединяются концы экзонов и выщепляется интрон. Третья такая же реакция превращает интронную последовательность в кольцо. А когда оно размыкается, опять происходит реакция переэтерификации и кольцевая форма восстанавливается, но уже в несколько укороченном виде.
Изучая механизм аутосплайсинга, мы (в этой работе участвовали мои коллеги Б. Басе, Ф. Салливэн, Т. Инуэ и М. Бин) все более убеждались в сходстве рибозима с классическими ферментами. Типичный ферментативный катализ состоит в том, что белок-фермент связывает два субстрата реакции (вещества, которые должны взаимодействовать) таким образом, что они в пространстве оказываются в непосредственной близости друг от друга и в ориентации, максимально облегчающей протекание химической реакции между ними. Интрон РНК, действует, как видно, точно так же, связывая гуанозин и ше-стипиримидиновую последовательность.
Однако сходство этим не ограничивается. Мы уже знали, что сворачивание нуклеотидной цепи интрона в пространстве столь же необходимо для проявления его каталитической активности, как трехмерная структура аминокислотной цепи для нормального белкового фермента. Во-первых, в результате сворачивания формируются участки связывания гуанозина и пиримидиновой последовательности. Во-вторых, как выяснилось в дальнейшем, когда интрон находится в свернутом состоянии, фосфатные группы в нужных для реакции участках активированы, т. е. их конформация благоприятна для разрыва фосфодиэфирной связи. Подтверждением этому служит тот факт, что даже в отсутствие гуанозина интрон претерпевает медленное расщепление в 3'-концевой точке сплайсинга и, еще более медленное, в 5'-концевой его точке. В данном случае роль атакующей группировки берут на себя ионы гидроксила (ОН-) из раствора.
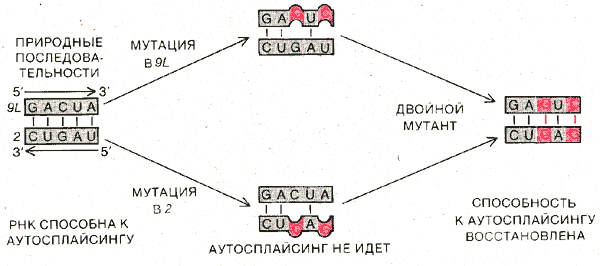
ЗНАЧЕНИЕ КОМПЛЕМЕНТАРНОСТИ определенных участков нуклеотидной последовательности интрона для его каталитической активности. К числу участков рРНКтетрахимены, важных для формирования пространственной структуры, необходимой для аутосплайсинга интрона, принадлежат элементы 9L', А, В, 9L, 9R и 2 (см. рисунок). В функционально активном интроне элемент 9L взаимодействует с элементом 2, образуя двухцепочечный участок. Если в каком-либо из этих элементов вызвать мутацию, нарушающую их комплемен-тарность, интрон теряет способность к аутосплайсингу (такой эксперимент был проведен автором в сотрудничестве с Дж. Бурке и его коллегами из Вильямс-Колледжа). При мутациях в обоих элементах комплементарность и каталитическая активность интрона могут восстанавливаться. Функциональное значение элементов 9R', Л, S, 9L и 2 подтверждается также тем, что они практически не менялись в ходе эволюции и присутствуют во всех сплайсирующихся РНК группы I, к которой относится и предшественник рРНК тетрахимены.
То, что в отсутствие гуанозина расщепление происходит медленнее, чем при его участии, неудивительно: в отличие от гуанозина ион ОН- не связывается интроном в положении, оптимальном для атаки фосфодиэфирной связи. Важно, что без гуанозина цепь РНК расщепляется в тех же точках, что и в полноценной реакции сплайсинга. Сама пространственная структура интрона, независимо от атакующей группы, каким-то образом способствует расщеплению фосфодиэфирных связей именно на концах вырезаемого интрона.
Почему и как конкретно при сворачивании интрона активируются фоcфаты в точках сплайсинга, мы не знаем, но это не мешает оценить эффективность такого способа активации. Обычно РНК весьма стабильна: без катализа ее фосфодиэфирные связи расщепляются очень медленно. В точках сплайсинга благодаря пространственной структуре интрона расщепление этих связей ускоряется в 1010 раз. Для наглядности скажем, что время реакции сокращается с 19 тыс. лет до 1 минуты!
Какова же пространственная структура интрона, придающая ему каталитические функции? Ответ на этот вопрос возник на основе исследований, казалось бы довольно далеких от нашей темы — сравнительного анализа РНК тетрахимены и РНК других организмов.
Речь о таком сравнении зашла потому, что в 1982 г. появились первые схемы классификации для реакций сплайсинга. Началось с того, что разные сплайсирующиеся РНК сгруппировали по степени сходства нуклео-тидных последовательностей их интронов. Получилось 4 группы молекул. Одна из них включала транскрипты, подвергающиеся процессингу в ядре, из которых в результате получаются молекулы тРНК. Другую группу составляли предшественники мРНК, процессинг которых также происходит в ядре. Остальные две группы, обозначаемые «группа I» и «группа II», объединяли более разнообразные РНК. В группу I входят интроны рРНК, мРНК и тРНК в основном из митохондрий и хлоропластов (цитоплазматических органелл, содержащих свои собственные ДНК, РНК и рибосомы). На сегодняшний день известно около 30 примеров интронов группы I (вполне возможно, их гораздо больше). Они идентифицированы у множества организмов в широком спектре от простейших до грибов и высших растении, таких, как пшеница и бобы (однако не найдены у животных). Интроны группы II — это в основном РНК из митохондрий грибов и хлоропластов растений; они распространены, по-видимому, не так широко, как представители группы I.
Первоначально группа I включала интроны митохондрий грибов,имеющие одни и те же четыре нуклеотидные последовательности длиной приблизительно 10 нуклеотидов каждая. Вскоре стало ясно, что от этих последовательностей существенно зависит функционирование интронов группы I, в особенности их трехмерная структура, важная для сплайсинга. Первые указания на связь между структурой и функционированием нитронов обнаружились в 1982 г., когда сразу несколько исследователей обратили внимание на то, что в интроне тетрахимены (а эта РНК синтезируется не в митохондриях, а в ядре клетки) есть те же консервативные элементы нуклеотидной последовательности, что и в интронах группы I.
Наличие общих элементов структуры тем более удивительно, что рассматриваемые РНК происходят из совершенно разных объектов. Грибы и простейшие считаются эволюционно далекими друг от друга организмами, а нуклеиновые кислоты митохондрий обычно значительно отличаются от аналогичных молекул из ядра клетки. Сохранение в ходе эволюции в неизменном виде тех или иных участков нуклеотидной последовательности обычно означает, что эти консервативные элементы выполняют в клетке важную функцию, которая не должна исчезать в процессе дивергентной эволюции.
При учете того, что было известно об интроне тетрахимены, казалось разумным следующее предположение: консервативные последовательности интронов группы I нужны для формирования определенной пространственной структуры молекулы, обеспечивающей аутосплайсинг.
Попытки установить пространственную организацию структурного остова интрона были предприняты одновременно в нескольких лабораториях. Результаты, полученные разными исследователями, хорошо согласуются, что само по себе свидетельствует об их истинности. Ф. Мишель и Б. Дюжон из Центра молекулярной генетики в Жифсюр-Иветт (Франция) и Р. Дэвис из Манчестерского университета независимо друг от друга предположили, что благодаря консервативным участкам нуклеотидной последовательности все интроны группы I имеют сходную пространственную структуру или, как минимум, сходный структурный остов.
Один из способов того, как консервативные нуклеотидные последовательности могут обеспечивать определенную трехмерную структуру, заключается в их связывании друг с другом. Из четырех нуклеотидов, входящих в состав РНК, могут образоваться две комплементарные пары: А — U и G — С. В такой паре между нуклеотидами устанавливаются слабые химические связи, называемые водородными. Водородные связи между комплементарными нуклеотидами удерживают вместе две нуклеотидные цепи двойной спирали молекулы ДНК. Точно так же могут взаимодействовать два участка РНК, имеющие комплементарные последовательности нуклеотидов. Благодаря комплементарному спариванию консервативных нуклеотидных последовательностей интрон сворачивается в определенную пространственную структуру. Модель ее была предложена Мишелем и Дэвисом на основании анализа нуклеотидных последовательностей.
В это же самое время мы исследовали пространственную укладку интрона биохимическими методами. На основании структурных данных, полученных в нашей лаборатории Н. Кайлом Тэннером, и компьютерной программы, разработанной М. Цукером из Национального совета научных исследований Канады, была построена модель структуры интрона. Наша модель удивительно хорошо совпала с моделью Мишеля и Дэвиса. Это совпадение убеждает, что модели в целом верны и что описываемая ими структура играет непосредственную роль в процессе аутосплайсинга.
Другие данные тоже свидетельствуют о правильности такого предположения. Генетики, изучавшие экспрессию митохондриальных генов в дрожжах, обнаружили мутации, изменяющие короткие консервативные последовательности в интронах группы I и приводящие к нарушению сплайсинга. Позже нам совместно с Дэвисом и его коллегами удалось «испортить» консервативные последовательности в интроне тетрахимены и показать, что это тоже нарушает аутосплайсинг.
Из этих результатов явно следует, что консервативные элементы нуклеотидных последовательностей интронов группы I участвуют в формировании их трехмерной структуры, необходимой для каталитической функции. Однако ввиду того, что детальная пространственная структура интрона еще не установлена, многие вопросы пока остаются не решенными. Мы надеемся, что вскоре удастся понять, как конкретно благодаря трехмерной структуре остова интрон сближает нужные субстраты и способствует реакции между ними.
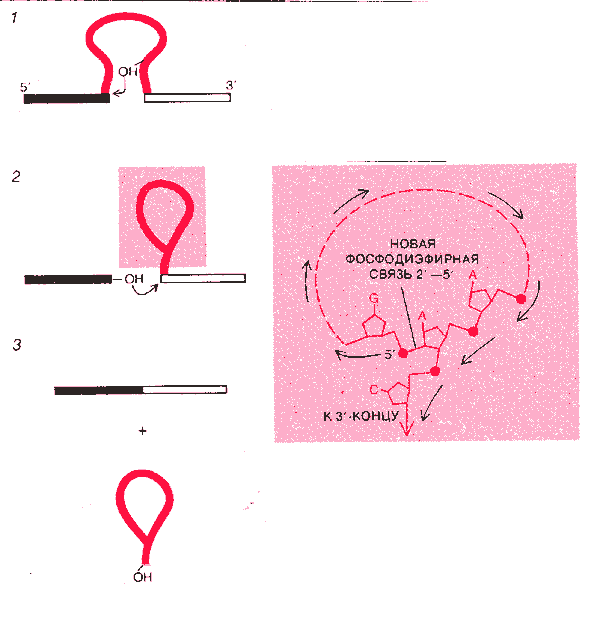
СТРУКТУРА ТИПА ЛАССО образуется при выщеплении интронов из РНК группы II. Некоторые интроны группы Н аутосплайсируются, но не нуждаются при этом в гуанозине. Вместо него атаку 5'-участка сплайсинга осуществляет одна из множества 2'-гидроксильных групп самого интрона (1). В результате реакции 5'-конец интрона присоединяется не к его 3'-концу, а на некотором расстоянии от 3'-конца, так что образуется разветвление с петлей — лассо (2). Разветвление получается из-за возникновения новой 2'—дифосфодиэфирной связи, в результате чего один из адениновых нуклеотидов образует не 2, как обычно, а 3 связи с соседними нуклеотидами (вверху справа). При соединении экзонов лассо выщепляется (3).
По мере того как выявлялась взаимосвязь между структурным остовом и аутосплайсингом, выяснялось, что интрон тетрахимены далеко не уникален в отношении аутосплайсинга. С одной стороны, это придавало уверенности в правильности наших результатов, а с другой — новые данные были не столь уж удивительны. В самом деле, если митохондриальные интроны группы I и интрон тетрахимены имеют похожую структуру и у тетрахимены она используется для аутосплайсинга, то почему бы не предположить, что интроны группы I тоже способны к аутосплайсингу?
Данные, полученные недавно несколькими группами исследователей, подтвердили это предположение. Дж. Гарриджа и А. Ламбовиц из Сент-Луисского университета показали, что интрон митохондриальной мРНК грибка Neurospora crassa аутосплайсируется. X. Табак с коллегами в Амстердамском университете обнаружили аутосплайсинг некоторых интронов мРНК и рРНК из митохондрий дрожжей. Во всех случаях для аутосплайсинга был необходим гуанозин и механизм сплайсинга был такой же, как у тетрахимены. Интересно, что, как впоследствии было обнаружено, РНК из бактериального вируса, т. е. биологически совершенно иного объекта, обладает теми же свойствами. М. Белфорт, Ф. Мали и их коллеги из отдела здравоохранения шт. Нью-Йорк в Олбани обнаружили, что РНК бактериофага Т4 может сама себя сплайсировать в клетках E. coli.
Открытие Белфорт и Мали еще более расширило спектр организмов, обладающих механизмом сплайсинга группы I, - от бактериальных вирусов до высших организмов. А совсем недавно аутосплайсинг был обнаружен и у интронов группы II. В 1986 г. К. Пиблс, сотрудник Питтсбургского университета, работающий совместно с Ф. Перлманом из Университета шт. Огайо, а также Л. Гривелл и его коллеги из Амстердамского университета показали, что предшественник мРНК из митохондрий (эта мРНК относится к группе II) может сам вы-щеплять собственный интрон. Причем механизм аутосплайсинга РНК группы II отличается от механизма группы I. Во-первых, он не нуждается в гуанозине и вообще ни в каком ином свободном нуклеотиде. А во-вторых, в процессе аутосплайсинга образуется структура, не свойственная интрону тетрахимены и родственным РНК из других организмов, - структура типа «лассо».
Лассо представляет собой петлю, образуемую нуклеотидной цепью интрона при его выщеплении из первичного транскрипта. При этом петля получается не за счет соединения концов интрона, а в результате возникновения связи между одним из его концов и нуклеотидом, расположенным на некотором расстоянии от другого конца, так что небольшой концевой фрагмент РНК интрона оказывается не включенным в кольцо. Эта структура имеет некоторое сходство с лассо, которым пользуются ковбои, - отсюда и ее название.
Интересно, что структура типа лассо, подобная образующейся при сплайсинге интронов группы II, уже была известна: она появляется при сплайсинге предшественников мРНК в ядре. Сплайсинг ядерных пре-мРНК зависит от присутствия белков, и поэтому считалось,что он катализируется белковыми ферментами. Открытие того, что при аутосплайсинге интронов группы II образуется лассо, позволяет предположить, что рибози-мы играют какую-то роль при сплайсинге и ядерных пре-мРНК. Более того, интроны группы II, возможно, представляют эволюционный мостик между предшественниками ядерных мРНК и аутосплайсирующимися инт-ронами группы I.
Хотя было ясно, что аутосплайсирующаяся РНК имеет много общих свойств с ферментами, одно существенное различие все же оставалось: рибозим катализировал реакции, затрагивающие его самого, а не другие молекулы. Так как в результате аутосплайсинга сам рибозим претерпевал изменения, его нельзя было считать катализатором в строгом смысле слова. Поэтому некоторые исследователи относили рибоэимы и ферменты к совершенно разным категориям. Но вот через два года после открытия аутосплайсинга и это различие исчезло.
В 1983 г. С. Альтман с сотрудниками из Йельского университета в содружестве с группой исследователей под руководством Н. Пейса из Еврейской национальной больницы в Денвере занимались исследованием рибонуклеазы Р. Рибонуклеаза Р — фермент процессинга тРНК, имеющийся как в бактериях, так и в клетках высших организмов. Этот фермент необычен тем, что состоит из молекулы РНК и молекулы белка, действующих «в единой упряжке». Альтман с коллегами ранее показали, что в клетке оба компонента — и РНК и белок — необходимы для того, чтобы нуклеаза могла выполнять свою функцию — разрезать предшественник тРНК в определенном месте. Однако Альтман и Пейс обнаружили, что «в пробирке» для правильного разрезания предшественника тРНК достаточно РНК, в то время как одна белковая субъединица фермента такую реакцию осуществить не могла.
В начале 1984 г. Альтман опубликовал окончательное доказательство того, что РНК рибонуклеазы Р является ее каталитической субъединицей. Была проведена транскрипция этой РНК с искусственной рекомбинант-ной молекулы ДНК и было показано, что полученный транскрипт обладал специфической рибонуклеаэной активностью — катализировал правильный процессинг предшественника тРНК. Таким образом, исключив возможность того, что катализ связан с белковыми примесями, этот эксперимент продемонстрировал,что по крайней мере in vitro РНК способна выступать в роли фермента в полном смысле слова. Вероятно, белок, не обладая сам каталитической активностью, помогает РНК функционировать в условиях внутриклеточной среды.
Недавно Заугу и мне удалось обнаружить, что укороченная форма интрона тетрахимены также может действовать как истинный фермент. К этому эксперименту нас привело размышление о том, каким образом происходит циклизация интрона. Обе последовательные реакции циклизации интрона осуществляются в принципе одинаково: связывается и отщепляется 5'-конец интрона, а остальная его часть в результате реакции переэтерификации замыкается в кольцо. По сути, это такая же реакция, как выщепление интрона из РНК-предшественника, и отщепляемый фрагмент РНК тоже должен содержать пиримидиновую последовательность, способную взаимодействовать с участком связывания.
После того как интрон дважды замкнулся в кольцо, он теряет способность к циклизации — в основном, вероятно, из-за того, что отщепившиеся от него 19 нуклеотидов содержали единственные доступные для связывания пиримидиновые последовательности. Однако это еще не означает, что такая укороченная молекула не имеет каталитической активности. И мы рассудили, что если укороченному интрону L—19 IVS «предложить» новый субстрат, то он, быть может, заработает как настоящий фермент.
Именно так и произошло, когда Зауг добавил в раствор, содержащий L— 19 IVS, короткие пиримидиновые цепочки РНК (в этом эксперименте они состояли только из остатков цитозина — С). Оказалось, что интрон обладает способностью расщеплять и соединять пиримидиновые фрагменты точно так же, как он расщепляет и воссоединяет свою собственную нуклеотидную цепь при наличии в ней пиримидиновой последовательности. Притом сам L—19 IVS после каждого реакционного акта оставался неизменным и готовым снова к такому же действию. Словом, L—19 IVS вполне удовлетворял классическому определению катализатора.
Хотя мы и ожидали, что укороченная форма интрона обладает настоящей ферментативной активностью, нас удивила высокая эффективность ее функционирования в качестве фермента. L—19 IVS способен расщеплять и воссоединять цепь из цитозинов около 100 раз за час. Даже несмотря на то что для такой реакции как для истинного каталитического акта необходимо, чтобы в растворе произошла встреча двух молекул, весь процесс под действием L— 19 IVS происходит с той же скоростью, что и аутосплайсинг.
Был и еще один повод для удивления. В результате повторяющихся актов расщепления и воссоединения пиримидиновые цепочки удлинялись: L—19 IVS синтезировал полимер из цитозинов! Это очень важный факт, так как полимеризация РНК — необходимая предпосылка для репликации (т. е. синтеза копий) генов, образованных из РНК, а именно такие гены, как считается, были у истоков жизни.
Некоторые исследователи полагают, что открытие аутосплайсинга и природы ферментативной активности рибонуклеазы Р разрешило долгий спор о том, что раньше возникло в эволюции: яйцо или курица — нуклеиновые кислоты или белки. Открытие того, что интрон тетрахимены обладает некоторой способностью к синтезу РНК, ставит гипотезу о первичной роли РНК на более прочную основу, поскольку свидетельствует о возможности (по крайней мере в принципе) аутокаталитической репликации РНК. Теперь уже разумно предполагать, что первым шагом к возникновению жизни была репликация РНК без участия каких бы то ни было белков.
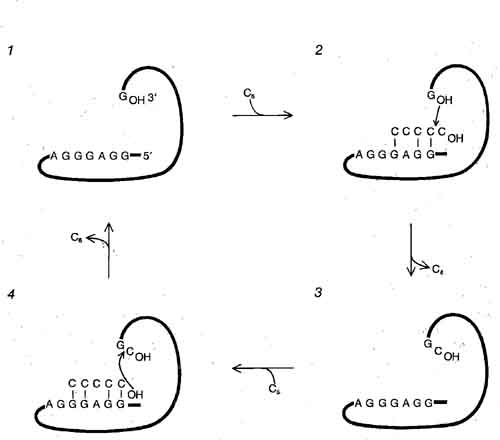
ИСТИННЫЙ КАТАЛИЗ, осуществляемый интроном - катализ реакций, происходящих с другими молекулами, а не с ним самим, - был впервые продемонстрирован для интронной РНК L-19 IVS тетрахимены. BL-19 IVS по сравнению с исходным интроном отсутствует последовательность на 5'-конце, которая могла взаимодействовать с участком связывания GGAGGG. В то же время сам участок связывания имеется (7) и он способен взаимодействовать с другими молекулами, имеющими комплементарную последовательность нуклеотидов, например с цепочкой из пяти цитозинов (2). Концевой цитозин остается связанным с гуанозином на 3'-конце интрона (3), а четырехцитозиновый фрагмент отделяется. Затем интрон связывает другую цепочку из пяти цитозинов и происходит атака связи между цитозином и гуанозином интрона (4). В результате образуется цепочка уже из шести цитозинов, которая может служить субстратом для присоединения следующего цитозина (не показано). В лаборатории автора наблюдали синтез РНК длиной до 30 цитозинов.
Совершив этот небольшой экскурс в прошлое, заглянем теперь в будущее: попытаемся вообразить, какие могут быть обнаружены новые примеры каталитической активности РНК. Во всех известных на сегодня случаях субстратом для ферментативного действия РНК является сама РНК — участки той же полимерной молекулы, другая полимерная молекула РНК или же единичный нуклео-тид. Вероятно, это не случайно. РНК прекрасно подходит для взаимодействия с РНК, и гораздо труднее представить, как она может сформировать хороший центр связывания, предназначенный для взаимодействия с иными важными биологическими молекулами, скажем, с аминокислотами или жирными кислотами. Поэтому, как мне кажется, если и будут найдены другие примеры каталитической активности РНК, субстратом в них тоже должна быть РНК.
Разумно выглядят две возможности. Одна из них предполагает участие маленьких рибонуклеопротеидных частиц, присутствующих в ядрах клеток, — так называемых частиц мяРНП (малые ядерные рибонуклео-протеиды), которые необходимы,для многих реакций «созревания» РНК в ядре, включая сплайсинг. Каждая частица мяРНП состоит из молекулы РНК и нескольких молекул белков. Не исключено, конечно, что эти частицы просто отмечают, как маркеры, в предшественнике мРНК те точки, в которых «обычные», белковые ферменты должны осуществить сплайсинг. Но по моему мнению, мяРНП принимают непосредственное участие в катализе.
Другая возможность связана с ри-босомой. Рибосома состоит из 55 или более молекул разных белков и нескольких молекул РНК. Некоторые из субстратов, с которыми приходится иметь дело рибосоме, тоже представляют собой РНК — тРНК и мРНК. Работы многих исследователей, и прежде всего группы под руководством К. Возе из Иллинойсского университета в Эрбана-Шампейн и Г. Ноллера-младшего с сотрудниками из Калифорнийского университета в Санта-Крусе, показали, что в ходе эволюции пространственная структура рРНК менялась очень мало. Этот результат и тот факт, что существуют мутации рибосомных РНК, влияющие на синтез белков, можно интерпретировать как указание, что рРНК непосредственно участвуют в синтезе белка.
Если будет обнаружено, что синтез белка — одна из основных биосинтетических активностей в клетке — катализируется РНК, это нанесет окончательный удар представлению о том, что все ферментативные функции в клетке выполняются белками. Конечно, все может обстоять далеко не так. Вполне вероятно, что рибосома является нерасторжимым комплексом РНК с белками и что окажется невозможным отнести ее каталитическую активность к тому либо к другому компоненту. Тем не менее независимо от того, удастся ли доказать ферментативную активность рибосомной РНК, за последние пять лет в биохимии подверглась пересмотру фундаментальная идея, а именно: что есть фермент. Стало очевидным, что, по крайней мере в некоторых случаях, функция хранения информации и каталитическая функция могут сосуществовать в одной и той же молекуле — РНК. И сейчас мы еще только начинаем понимать истинное значение такого совмещения функций.
(Последние исправления - 7.3.2002)