
Б.ЛЬЮИН
Гены
Перевод с английского канд.биол.наук А.Л.Гинцбурга, д-ра биол.наук Т.С.Ильиной, канд. биол. наук Э. С. Каляевой и канд. биол. наук Т. Ю. Переслени
под редакцией чл.-корр. АН СССР Г.П.Георгиева
Москва «Мир»
1987
Часть Х
ДИНАМИЧНОСТЬ ГЕНОМА:
ПОСТОЯННОЕ ИЗМЕНЕНИЕ ДНК
Глава 37
Мобильные элементы эукариот
Вездесущность транспозирующихся элементов может рассматриваться либо как доказательство их важности для эукариот и прокариот, либо как указание на то, что они одинаково успешно размножаются в составе геномов любого типа. Вместе с плазмидами, способными переносить генетическую информацию между бактериями, транспозоны прокариот обеспечивают подвижность генов хозяина (с успехом компенсируя отсутствие истинного полового процесса). В некоторых случаях механизмы, подобные транспозициям, вовлекаются в регуляцию генов. У эукариот, с другой стороны, уже известны отдельные случаи, когда перемещение последовательностей из сайта или в специфические сайты играет роль в регуляции генов. В их геномах найдены также элементы, сравнимые с бактериальными транспозонами, способные перемещаться в случайно выбираемые места генома.
Мобильные элементы, наиболее близкие по своим свойствам к бактериальным транспозонам, были обнаружены у S. cerevisiae и D. melanogaster. Они имеют небольшой размер, содержат концевые повторы и найдены в различных участках геномов. Очевидно, что в состав этих элементов входят гены, продукты которых необходимы для транспозиции; включены ли в них гены, кодирующие второстепенные функции, не связанные с транспозиционным событием, не известно.
Каждый из этих элементов аналогичен бактериальным транспозонам, которые представляют собой последовательности, способные перемещаться в пределах хозяйского генома. Транспозоны про- и эукариот, по-видимому, не могут существовать вне генома.
Функции, связанные с осуществлением транспозиции у эукариот, пока не установлены; нам еще предстоит идентифицировать продукты эукариотических генов, участвующих в этом процессе.
Явление транспозиции было описано много лет назад Мак-Клинток, проводившей генетические исследования на кукурузе. До совсем недавнего открытия этого эффекта у бактерий полученные ею результаты оставались «в вакууме», однако сейчас события, связанные с транспозицией, могут быть изучены на молекулярном уровне и у эукариот. На кукурузе получена значительная информация о генетических взаимодействиях между членами семейства транспозонов, об эффектах их внедрения в определенные локусы и различных результатах транспозиционного события.
В составе геномов животных мобильные элементы еще не найдены, но обнаружены следы транспозиционных событий в форме прямых повторов мишени, фланкирующих диспергированные повторяющиеся последовательности. Механизмы, подобные транспозиции, по-видимому, используются ретровирусами, чтобы внедрять ДНК-копии своего РНК-генома в хромосомы клеток хозяина. Эти случаи обсуждаются вместе с другими примерами вариабельности эукариотической ДНК в гл. 38. Молекулярные механизмы транспозиции в клетках эукариот еще не изучены так тщательно, как у бактерий; в частности, еще не идентифицировали продукты генов эукариотического транспозона. Однако присутствие коротких прямых повторов ДНК мишени позволяет предполагать использование сходного механизма, при котором такая «генерализованная» транспозиция выбирает случайные сайты для внедрения. Нам бы хотелось знать, какова взаимосвязь между транспозирующимися элементами различных видов и могут ли функции транспозиции сохраняться при перемещении элемента из одних видов в другие.
Другой тип событий представляют «направленные» транспозиции, при которых перемещение последовательностей из одного специфического сайта в другой имеет регуляторный эффект. У бактерий существует очевидная взаимосвязь между механизмами сайтспецифической инверсии и транспозиции. У эукариот направленное перемещение ДНК может осуществляться с помощью иных механизмов. Например, у дрожжей наблюдается однонаправленный перенос копий генов, определяющих тип скрещиваемости, из «молчащих» локусов в «активные». Этот процесс напоминает бактериальную транспозицию, когда донорный локус остается интактным, а реципиентный изменяется; однако у дрожжей существует только один реципиентный локус, который сам инициирует перенос, вместо того чтобы остаться «пассивной» мишенью. Иная ситуация имеет место в случае иммуноглобулиновых генов. Здесь в результате рекомбинации меняется содержание генома, создаются активные гены в соответствующих соматических клетках (гл. 39). Диапазон изменений в геноме, таким образом, простирается от случайных транспозиций к тканеспецифичным перестройкам.
Элементы Ту дрожжей представлены семейством разобщенных повторяющихся последовательностей ДНК. Каждый элемент состоит из 6,3 т.п.н.; последние 330 пар в его концах представлены прямыми повторами, названными дельта-повторами - d. В различных штаммах S. cerevisiae число Ту-элементов варьирует, но в обычных лабораторных культурах оно колеблется в пределах от 30 до 35. Наряду с интактными Ту-элементами встречается примерно 100 независимых элементов d, называемых одиночными. Название Ту представляет собой сокращение от английских слов transposon yeast, что означает «транспозон дрожжей»; наличие функций транспозиции у этого элемента предполагают на основании данных, показавших его присутствие в различных сайтах разных штаммов. До сих пор частота транспозиции Ту-элементов еще не определена, но, по-видимому, она ниже, чем частота перемещения бактериальных транспозонов. Перемещение Ту-элементов было прослежено благодаря отбору мутаций, вызываемых их внедрениями в регуляторные локусы, поэтому большая часть имеющейся информации об эффектах, вызываемых Ту-элементами, касается генов, смежных с сайтами внедрений.
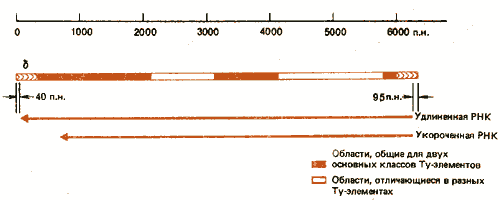
Рис. 37.1. Ту-элементы содержат на концах короткие прямые повторы и транскрибируются с образованием двух перекрывающихся РНК.
Наблюдается значительная дивергенция между отдельными Ту-элементами. Большинство из них попадает в один из двух основных классов, получивших название Tyl и Ту917. Их взаимосвязь показана на рис. 37.1. Элементы обоих классов фланкированы дельта-повторами. Общим в их структуре является также присутствие длинных областей в левом конце, в середине и короткой области, прилегающей к правой дельта-последовательности. Судя по результатам рестрикционного картирования и гетеродуплексного анализа, две основные области замещения не проявляют гомологии. Отдельные Ту-элементы каждого класса могут отличаться от своего прототипа одним или несколькими основаниями, вставками или делециями. Значительная гетерогенность характерна и для d-последовательностей, хотя более вероятно, что оба повтора одного Ту-элемента идентичны или по крайней мере очень близки. (Самый выраженный случай дивергенции соответствует шести различиям в 330 парах оснований). Не известно, чем обусловлена идентичность терминирующих последовательностей d-элементов: конверсией, происходящей до или после транспозиции, или тем, что оба повтора «нового» Ту-элемента образуются из одного повтора донора. Дельта-последовательности, связанные с Ту-элементами, проявляют большую степень консерватизма, чем отдельные дельта-элементы, что позволяет предполагать, что в процесс транспозиции включается узнавание повторов.
Транспозиция Ту-элемента, так же как и бактериальная транспозиция, сопровождается образованием повторов из 5 пар оснований с каждой стороны от внедренного элемента. Мы не знаем происхождения фермента (ферментов), необходимого для транспозиции Ту-элементов; широкое разнообразие последовательностей этих элементов вызывает сомнения в транспозонном происхождении ферментов.
Присутствие Ту-элементов обеспечивает наличие областей частичной гомологии, в которых могут происходить рекомбинационные события, контролируемые системами хозяина. Обычно такие события сводятся к индукции делеций или инверсий в хромосоме (путем рекомбинации между двумя находящимися в ней Ту-элементами) или более существенных изменений, вызываемых рекомбинацией между Ту-элементами из разных хромосом. По-видимому, рекомбинация между Ту-элементами происходит по типу «взрывов»: осуществление одного рекомбинационного события с большой вероятностью влечет за собой последующие акты рекомбинации. Следует отметить, что для Ту-элементов характерен и такой тип взаимодействия, как конверсия гена; она происходит между элементами, локализующимися в различных местоположениях.
Ту-элементы способны вырезаться при участии гомологичной рекомбинации между прямыми повторами d-последовательностей, что приводит к появлению большого числа отдельных d-элементов. Вырезание такого типа может быть связано с реверсией мутаций, вызванных внедрением Ту; частота реверсий зависит от точки вырезания.
Ту-элемент транскрибируется в два вида poly(A)+-РНК. Как показано на рис. 37.1, оба вида РНК инициируются приблизительно в области 95-й пары оснований от правого конца элемента. Терминация синтеза одной из них происходит на расстоянии 5 т.п.н. от точки инициации в пределах общей последовательности левого конца; синтез другой РНК терминируется на расстоянии 5,7 т.п.н. в пределах 40 пар оснований левой пограничной области. Следовательно, более длинная РНК начинается и кончается в пределах d-последовательностей и поэтому имеет повторы на своих концах. Парадокс состоит в том, что оба элемента d содержат одинаковые последовательности, однако промотор активен в правом элементе, а терминатор - в левом. Аналогичная особенность обнаружена и в других транспозирующихся элементах (включая ретровирусы, описанные в гл. 38). Мы не знаем, осуществляется ли трансляция Ту-РНК с образованием белка.
Вывод о существовании мобильных элементов у D. melanogaster был сделан на основании наблюдений, аналогичных тем, которые позволили идентифицировать первые инсерционные последовательности у Е. coli. Были обнаружены нестабильные мутации, ревертирующие к дикому типу или вызывающие делеций в областях, прилегающих к исходному сайту мутации. Прямые доказательства наличия нескольких типов транспозирующихся последовательностей удалось получить при изучении локализации определенных компонентов повторяющихся последовательностей ДНК.
Наиболее изучено семейство элементов, получивших название copia. Название свидетельствует о присутствии большого числа близкородственных последовательностей, кодирующих множество мРНК. Семейство copia берется за образец для нескольких других типов элементов, структура и общие свойства которых, по-видимому, очень сходны, однако последовательности не являются родственными. Они описываются как copia-подобные элементы [В советской литературе обычно используется термин мдг-элементы (мобильные диспергированные генетические элементы). Именно для одного из них (мгд 1) была впервые показана подвижность в геноме. - Прим. ред.]. Список таких элементов приведен в табл. 37.1. Вместе взятые, элементы copia-подобных семейств составляют более 1% ДНК D. melanogaster.
Число копий этих элементов зависит от линии мухи; обычно оно колеблется между 20 и 60. Члены семейства сильно отличаются друг от друга. При сравнении геномов мух различных линий с помощью рестрикционного анализа фрагменты, гибридизующиеся с copia-специфичной пробой, обнаруживают в каждой линии различный, хотя и перекрывающийся спектр последовательностей. С помощью гибридизации in situ с политенными хромосомами установлено, что последовательности copia присутствуют в разных (и в этом случае перекрывающихся) сериях сайтов. О вариабельности распределения copia свидетельствует тот факт, что в каждой из нескольких исследованных линий последовательности copia обнаружены в разных сайтах. Эти различия выработаны в процессе эволюции. Сравнение линий, которые дивергировали в процессе их размножения в лаборатории, в течение последних 40 лет обнаружило мало изменений. В настоящее время мы не можем оценить скорость изменчивости. Однако о природе лежащих в ее основе событий свидетельствуют результаты наблюдений за ростом клеток в культуре. Число элементов copia на геном в этих условиях увеличивается, по существу, в 2-3 раза. Дополнительные копии элементов представлены внедрениями последовательностей элементов copia в новые сайты. Процесс адаптации клеток в культуре каким-то непонятным способом временно увеличивает частоту транспозиции до 10-3-10-4 событий на поколение.
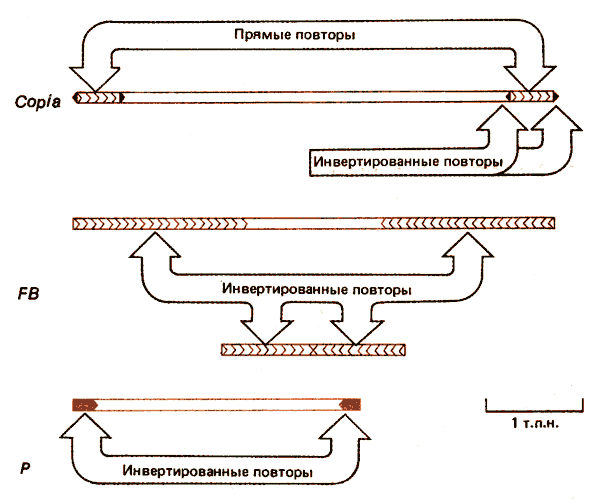
Рис. 37.2. Три типа мобильных элементов у D. melanogaster имеют различную структуру.
Схематическое изображение элемента copia представлено на рис. 37.2; данные, характеризующие его структуру, приведены в табл. 37.1. Элемент имеет протяженность, равную 5000 пар оснований, и содержит идентичные прямые концевые повторы из 276 пар оснований. Каждый из прямых повторов заканчивается сходными инвертированными повторами. В сайте интеграции образуется прямой повтор из 5 пар оснований ДНК мишени. Среди известных сайтов внедрения общая последовательность не выявлена, хотя региональная предпочтительность, свойственная некоторым бактериальным транспозонам, вероятно, может существовать. Дивергенция между отдельными членами семейства copia незначительная (менее 5%), варианты часто содержат небольшие делеции. Все эти особенности касаются и других copia-подобных семейств, хотя их отдельные члены могут проявлять большую степень дивергенции. Например, максимальная дивергенция, обнаруженная в случае элемента 297, достигает ~ 20%.
Таблица 37.1
Типы транспозирующихся элементов у D. melanogaster

Транспозирующиеся элементы D. melanogaster, напоминающие по организации copia: 412, 297, mgdl, mgd3,В104 и gypsy. Число копий этих элементов варьирует от 10 до 1000 на геном; их длина колеблется от 5500 до 8500 п.н., длина прямых повторов - от 269 до 571. Длина повторов мишени составляет обычно 4 или 5 оснований.
Идентичность двух прямых повторов каждого элемента свидетельствует, что они либо взаимодействуют между собой, что ведет к исправлению отклонений, либо образуются из одного прямого повтора предшествующего элемента во время транспозиции. (Мы уже рассматривали аналогичные особенности Ту-элементов дрожжей; это также характерно и для ретровирусов; см. гл. 38). Элементы copia в геноме всегда интактны; отдельные копии концевых повторов не были обнаружены (хотя можно было бы ожидать их возникновения в результате рекомбинационных событий, делетирующих промежуточный материал). С другой стороны, элементы copia иногда существуют в форме свободных кольцевых молекул ДНК, что отличает их от бактериальных транспозонов, не образующих свободных форм. Два главных типа кольцевых молекул в популяции элементов copia представлены структурами протяженностью в 5000 и 4700 пар оснований. Последние имеют делецию, захватывающую один из концевых повторов (которая была бы естественной, если бы кольцевые молекулы возникали в результате вырезания из хромосомы с помощью реципрокной рекомбинации).
Транскрипты copia присутствуют в виде многочисленных poly(A)+-мРНК, представляющих как полные, так и частичные транскрипты. мРНК имеют одинаковый 5'-конец, образующийся в результате инициации в середине одного из концевых повторов. Укороченная мРНК (две т.п.н.) содержит информацию для белка с мол. массой 51000, функции которого неизвестны. Так как прямые повторы идентичны, не исключено, что оба они функционируют в качестве промоторов, один из которых может использоваться для транскрибирования последовательности самого элемента с образованием copia-специфичных РНК, а другой - для транскрибирования генов в областях ДНК, прилегающих к сайту внедрения (такие же свойства характерны для ретровирусов).
Члены другого семейства мобильных элементов называемых FB(от англ, faldback), содержат инвертированные концевые повторы разной длины. Некоторые FB-элементы состоят исключительно из прилежащих друг к другу повторов; у других они отделены неповторяющейся последовательностью ДНК. Несмотря на вариации в длине, инвертированные повторы всех членов FB-семейства гомологичны. Это свойство обусловлено их структурой, которая представлена тандемными копиями простых последовательностей ДНК, разделенных длинными участками различающихся последовательностей. В направлении от конца к центру элемента длина простых повторяющихся единиц увеличивается: начинается с 10 п. н., затем увеличивается до 20 п. н. и, наконец, достигает 31 п.н. Две копии инвертированного повтора в одном элементе не идентичны. Инвертированные повторы внешне напоминают сателлитную ДНК. Представляет интерес их взаимосвязь у различных членов семейства. Структура концевых последовательностей FB-элементов необычна, поэтому не понятно, чем обусловлена их способность к транспозициям. Иногда два (неидентичных) FB-элемента кооперируются и переносят большой сегмент ДНК, расположенный между ними. В этом случае они напоминают сложные бактериальные транспозоны (хотя длина участка ДНК между FB-элементами может быть значительно больше). Известны два примера таких структур: одна из них имеет длину 200 т.п.н. и названа ТЕ (транспозирующийся элемент). Возможно, что любая последовательность ДНК, фланкированная на концах FB-элементами, способна вести себя как такая единица.
Другой тип транспозирующихся последовательностей представлен значительно меньшими по размеру Р-элементами; их максимальная длина достигает 2,9 т.п.н. Они содержат на концах короткие инвертированные повторы и транспозируются только в определенных условиях (см. ниже).
По структуре генов рРНК можно судить о возможности предшествующей локализации в этом локусе мобильного элемента. Примерно две трети генов, кодирующих 28S рРНК, у D. melanogaster имеют прерывистое строение. Промежуточные области можно отнести к двум классам, локализованным в пределах гена, в участках, отделенных 50-80 п. н. Ни один из типов разъединяющих последовательностей не может быть классифицирован как интрон, поскольку прерывистые гены не транскрибируются. Вполне вероятно, что существует связь между присутствием разъединяющих последовательностей и неспособностью генов инициировать транскрипцию в промоторе (который, по-видимому, идентичен промотору непрерывной последовательности генов), однако природа этой связи неясна.
В генах рРНК Х-хромосомы обнаружены внедрения последовательностей I типа. Последовательности гомологичны, но варьируют в длине от 0,5 до 5,0 т.п.н.; внедрения более коротких последовательностей могут быть результатом внутренних делеций в пределах исходной инсерционной последовательности протяженностью 5 т.п.н. Сравнение их структурной организации дано на рис. 37.3.
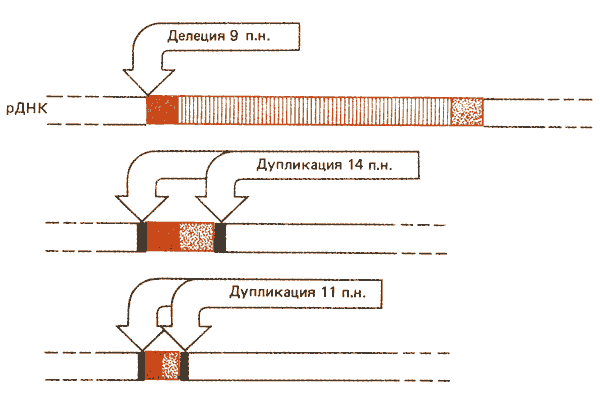
Рис. 37.3. Вставки рДНК типа I (красные сегменты) представляют собой гомологичные последовательности различной длины, вероятно образовавшиеся в результате внутренних делеций. В точке прерывания кодирующей последовательности вставка из 5 т.п.н. имеет делецию протяженностью в 9 п.н. рДНК; вставка из 1 т.п.н. содержит дупликацию рДНК протяженностью 14 п.н., а вставка из 500 п.н. - дупликацию рДНК длиной 11 п.н.
Инсерционные последовательности, содержащие 0,5 или 1,0 т.п.н., несут дупликации фланкирующей кодирующей последовательности из 14 или 11 пар оснований соответственно. Дупликации того же сайта мишени из 14 пар оснований присутствуют в прерывистых генах типа I у D. virilis. Возникают ли вставки I типа в результате транспозиции? По-видимому, дупликация сайта мишени была утрачена последовательностью из 5 т.п.н., поскольку вместо нее эта последовательность имеет делецию кодирующей последовательности с левой стороны вставки протяженностью в 9 пар оснований.
Последовательности, гомологичные инсерциям I типа, встречаются помимо генов рРНК в других положениях, что согласуется с представлением о них как о бывших транспозонах. Они часто встречаются в виде тандемных повторов, перемежающихся с негомологичной ДНК.
Инсерционные последовательности II типа обнаружены в генах рРНК как Х-, так и Y-хромосом. Их длина варьирует от 1,5 до 4,0 т.п.н. Несмотря на сложную структуру, они не родственны инсерционным последовательностям I типа и не проявляют каких-либо признаков, свидетельствующих об их транспозонной природе.
Рассмотрим некоторые особенности генома Drosophila, анализ которого стал возможным благодаря преимуществам, создаваемым мобильными элементами. Поведение нескольких локусов у D. melanogaster не согласуется с представлением о них как о генах, каждый из которых кодирует единственный продукт. Они получили название сложных локусов. Традиционный ген, даже прерывистый, идентифицируется на уровне генетической карты с помощью группы тесно сцепленных некомплементирующих между собой мутаций. Отличительным признаком сложных локусов является присутствие довольно разбросанных групп мутаций, занимающих относительно большой отрезок карты и проявляющих сложное поведение при комплементации. Например, мутации могут попадать в несколько перекрывающихся комплементационных групп, а их влияние на фенотип может быть сложным и неодинаковым у разных мутаций.
Примером локуса такого типа служит rudimentary, мутации в котором обусловливают глубокие изменения в морфологии крыла. Локусу rudimentary на карте соответствует участок размером около 0,07 единиц (примерно 35 т.п.н., если учитывать среднюю частоту рекомбинации). Другим примером может служить локус decapentaplegic, который нарушает развитие имагинальных дисков (личиночных тканей, из которых после метаморфоза формируются различные части тела взрослой мухи). Классическим локусом этого типа можно назвать локус bithorax. К нему относятся несколько групп мутаций, которые нарушают развитие грудного отдела, вызывая удвоение грудных сегментов и образование второй пары крыльев. Существующая в настоящее время модель предполагает наличие нескольких генов в локусе , bithorax (раньше их называли позиционными псевдоаллелями), кодирующих те продукты, которые участвуют в регуляции развития грудного отдела.
Локус w (white)был идентифицирован с помощью самой первой мутации, выделенной у плодовой мушки. Такая мутация определяла появление мужской особи с белыми или полупрозрачными глазами вместо обычных глаз красного цвета у особей дикого типа. Этот локус оказался интересным сам по себе; кроме того, его изучение дало информацию о событиях, включаемых в транспозицию разных элементов.
Мутации локуса wраспределяются в области, имеющей размер около 0,04 единиц генетической карты, и составляют только одну группу комплементации. Вот почему локус w вряд ли можно рассматривать как удачный пример сложного локуса. В то же время, поскольку у мутантных особей wглаза не окрашены, возникает вопрос о функции этого локуса. Дело в том, что у мух дикого типа цвет глаз обусловлен присутствием красного и коричневого пигментов, неродственных по структуре и синтезируемых разными путями. Были идентифицированы отдельные гены, нарушающие тот или иной путь (мутанты vermilion утрачивают коричневый пигмент, мутанты brown - красный и т.п.). Отсутствие продуктов обоих путей у мутантов w позволяет предполагать, что локус w+ не кодирует фермент, участвующий в образовании пигмента, а регулирует их продукцию. Мутанты w классифицируются в фенотипические группы согласно значимости эффекта мутаций на пигментообразование. Аллели, подобные исходному w1, ведут к полной утрате красного и коричневого пигментов. Другие аллели вызывают промежуточный фенотип, что связано с уменьшенной продукцией одного или обоих пигментов у этих линий. Обычно аллели различают по индексам, отражающим фенотипы, которые они обусловливают, например wa - аллель, определяющий абрикосовый цвет глаз, wi - цвет слоновой кости, we - эозиновый и т.д. Большинство аллелей влияет на качество пигмента, однако группа wsp влияет также на его распределение внутри глаза. Это согласуется с точкой зрения, что w контролирует распределение пигмента.
ДНК локуса w была клонирована с помощью метода, использующего преимущества, создаваемые присутствием элемента copia. в локусе wa (рис. 37.4). Геномную библиотеку линии wa подвергли скринингу с целью выделения клонов, несущих элементы copia. Выделенные химерные фаговые ДНК содержали все локусы, в которых присутствовал элемент copia.. Отдельные клонированные молекулы гибридизовали затем с политенными хромосомами мухи w+. Поскольку локус w такой мухи не содержит элемент copia., гибридизация в w происходит только с ДНК определенного клона, содержащего аллель wa, поскольку именно он несет последовательности w, фланкирующие сайт внедрения элемента copia.. Примерно 1 из 50 клонов попадает в эту категорию.
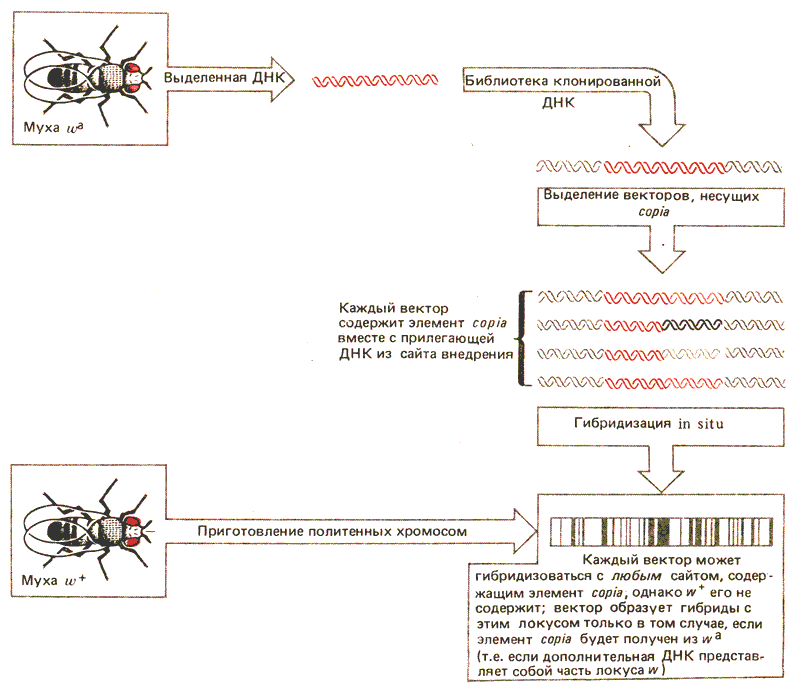
Рис. 37.4. Мобильные элементы могут быть использованы для выделения областей генома, фланкирующих сайт внедрения.
Любой сегмент локуса w, полученный в таком клоне, может быть использован для выделения всего локуса с помощью метода «прогулка по хромосоме», который представляет собой усовершенствованный вариант рестрикционного картирования. Он основан на использовании перекрывающихся фрагментов, полученных в результате разрывов генома в одной и той же области. Принцип метода иллюстрирует рис. 31.5.
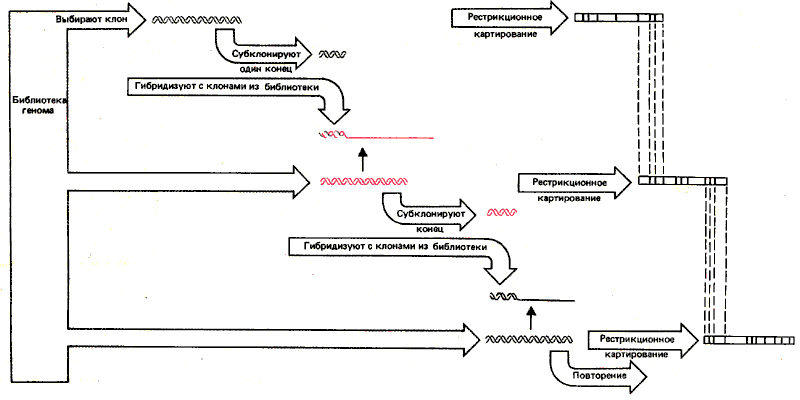
Рис. 37.5. «Прогулка по хромосоме» осуществляется путем последовательных актов гибридизации между перекрывающимися клонами генома.
Анализ начинается с клона, несущего фрагмент с интересующей областью или участком вблизи нее. Затем идентифицируются другие клоны, несущие последовательности, перекрывающиеся с последовательностью первого клона. Такие клоны будут содержать более протяженные последовательности с одной или другой стороны от фрагмента, содержащегося в первом клоне. Проводя в каждом случае рестрикционное картирование, можно определить, в каком именно направлении увеличен фрагмент нового клона. Фрагменты могут иметь довольно большую протяженность, поэтому удобно для выделения каждого следующего клона использовать субфрагмент неповторяющейся ДНК из конца предыдущего. Процесс может быть повторен неограниченно. Таким образом, оказывается возможным проанализировать сотни тысяч пар оснований. Следует отметить, однако, что, если область содержит многократно повторенную ДНК, многие гибридизующиеся клоны могут представлять совершенно различные области хромосом.
На рис. 37.6 представлена карта области, содержащей примерно 15 т.п. оснований, которая включает все известные сайты мутаций. Мутации классифицированы в соответствии с изменениями, которые они вносят в рестрикционную карту. Тип мутаций и их расположение соответствуют двум зонам с потенциально разными функциями.
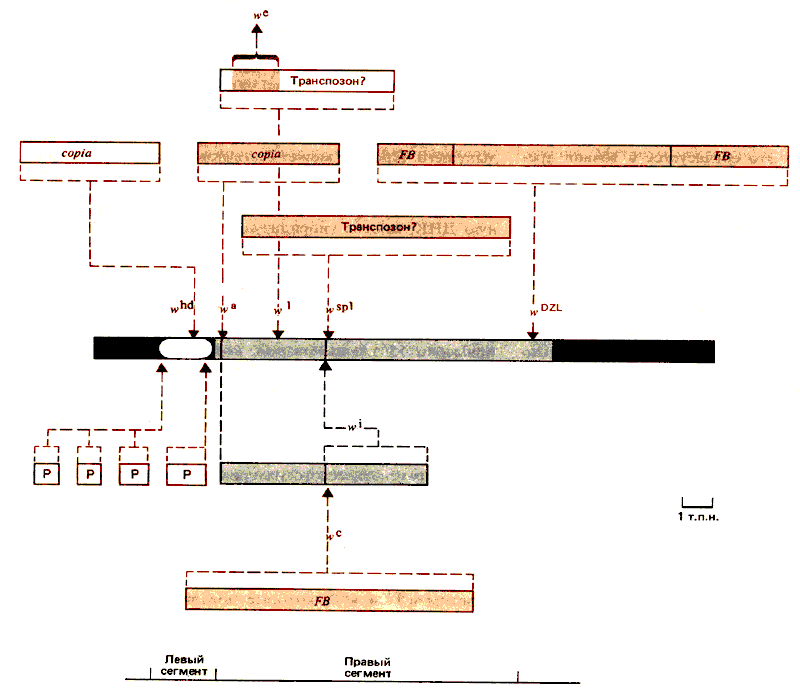
Рис. 37.6. Мутации в локусе white могут возникнуть в результате вставок, делеций или точковых замен. Область локализации потенциальных точковых мутаций на рисунке имеет белый цвет. Некоторые из этих мутаций обусловливают нулевой фенотип. Вставки, которые его вызывают, отмечены красным контуром. Вставки, обусловливающие очень слабое пигментообразование, обозначены темным цветом. Названия вставок, которые относятся к известным транспозирующимся элементам, указаны, другие обозначены как транспозоны, но со знаком вопроса.
Доказано, что многие мутации возникают в результате вставок генетического материала. В некоторых случаях такими вставками могут быть известные транспозирующиеся элементы, в других внедренная ДНК представляет семейство повторяющихся последовательностей и может оказаться неидентифицированным транспозирующимся элементом. Единственными поддающимися обнаружению делециями являются делеции участков, соответствующих аллелям wsp3 и wsp4, которые локализуются вблизи или в самом сайте внедрения wsp.
В локусе w идентифицированы потенциальные точечные мутации, которые могут не вызывать изменений в рестрикционной карте. Генетическое картирование показало, что все мутации такого типа локализованы слева от внедрения wa (этот участок на карте имеет белый цвет). Чтобы подтвердить, что эти мутации вызваны заменой оснований, необходимо определить последовательность оснований в данной области. Многие мутации обусловливают либо полную потерю функции локуса (глаза приобретают белый цвет), либо образование пигмента в мизерном количестве. Левый сегмент представляет потенциальную кодирующую область локуса. Об этом свидетельствует тот факт, что все инсерции в нем вызывают появление фенотипа «белых глаз», чего следует ожидать, если нарушенная область кодирует белок.
Мутации, картирующиеся справа от wa (включая этот сайт), почти всегда отличаются нестрогим (leaky) эффектом и обусловливают остаточную пигментацию. В этой области не найдено потенциально точечных мутаций; все мутации ведут к изменениям в рестрикционной карте. Подавляющее большинство мутаций представляют собой внедрения известных или предполагаемых подвижных элементов. (Атипичным аллелем является w1, исходный мутант с фенотипом «белые глаза»). Эти мутации и определяют правый сегмент, простирающийся от wa до wDLZ.
Поскольку внедрения в правом сегменте полностью не блокируют его функции, можно предположить, что вставки не прерывают кодирующий участок, а вмешиваются в осуществление какой-то другой функции, контролируемой смежной регуляторной областью. Вставки картируются в нескольких дискретных сайтах. Один из них wa, который находится на границе потенциально кодирующей области. Следующим является сайт w1, включающий серию вставок определенных последовательностей и их производных. В сайте wsp локализуется несколько вставок, делеций. Вставка wDLZ - самая удаленная в правом конце, возможно, именно она служит границей локуса. Весьма вероятно, что такие сайты внедрений идентифицируют отдельные регуляторные области; внедрения в другие сайты правого сегмента не вызывают появления мутантного фенотипа, доступного определению. Все мутации, которые повреждают потенциально регуляторные функции, такие, как синхронность исчезновения пигментов или их исчезновение в определенном порядке, дозовую компенсацию, картируются в правом сегменте.
Вывод о том, что вставки в правом сегменте оказывают непрямой эффект на активность продукта гена, подтверждается природой ревертантов. Изменения во внедренном сегменте часто приводят к изменению функции локуса. Например, делетирование небольшой части вставки w1 дает начало аллелю we, который в какой-то мере восстанавливает образование пигмента. Многие примеры эффектов такого типа позволяют заключить, что утрата функции не обусловлена только самим фактом внедрения вставки, а может зависеть и от природы, и от протяженности внедренного сегмента.
Реверсия не обязательно обусловлена утратой части внедренного материала, как это было показано на производных мутации w1. Эта мутация в отличие от других изменений, увеличивающих размер локуса, не связана с внедрением постороннего материала, а представляет собой тандемную дупликацию области из 3 т.п. н. внутри локуса w. Механизм реверсии здесь заключается в точной утрате дупликации, происходящей, вероятно, за счет внутрихромосомной рекомбинации с относительно высокой частотой (около 10-5).
Исключительным ревертантом оказался мутант wc, отличающийся малиновой окраской глаз; он возникал в результате внедрения в дупликацию wi элемента FB протяженностью 11 т.п.н. Аллель wc нестабилен, ревертирует с частотой ~ 10-3. При этом восстанавливается тип w1 или образуются стабильные производные с делециями, оканчивающимися в локусе w; представляется вероятным, что такие различные перестройки стимулируются FB-элементом. Удивительно, что такая большая вставка, как FB-элемент, способна восстановить фенотип, который был утрачен в результате внутренней дупликации. Возможно, что FB-элемент привносит новый промотор для поврежденного сайта, хотя имеются основания считать, что увеличение расстояния до других сайтов правого сегмента должно вызывать отрицательный эффект.
В сложных локусах обнаружен загадочный регуляторный эффект благодаря феномену так называемой трансвекцни. Этим термином обозначают способность хромосомных перестроек, предотвращающих спаривание гомологичных хромосом (как это показано для политенных хромосом), изменять фенотип, оставляя генотип в целом неизмененным. В основе эффекта лежит свойство мутаций из одного аллеля влиять на активность другого аллеля, пока эти аллели спарены. Следовательно, трансвекция может зависеть от какого-то структурного изменения, определяемого физическим контактом. Ее существование свидетельствует о возможности хромосомного спаривания в нормальных диплоидных клетках.
Причина явления трансвекции несколько прояснилась после выделения мутации wDZL (DZL-от англ, dominant zest-like). Вставка DZL в цис-положении подавляет функцию левой части области w. Этот эффект демонстрируется на рис. 37.7; аллель wDZL подавляет также экспрессию аллеля w+, находящегося в состоянии синапсиса с ним. Это не связано с доминантным эффектом в транс-положении, поскольку тот же самый аллель w+ экспрессируется нормально, если он транслоцирован в другой участок, и не попадает под влияние спаренного с ним аллеля wDZL.
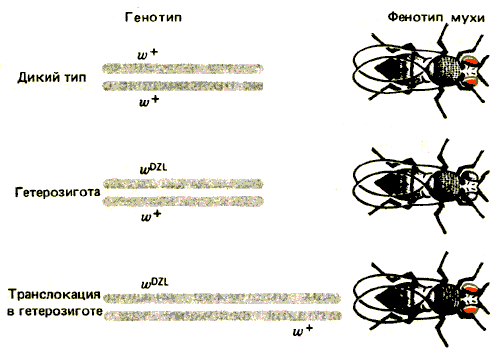
Рис. 37.7. Мутация wDZL предотвращает экспрессию аллеля w+, находящегося в состоянии синапсиса с ней, но не влияет на этот аллель, если он транслоцирован.
Аллель wDZL содержит внедренную последовательность длиной 13 т.п.н., состоящую из двух неидентичных FB-элементов, которые фланкируют сегмент негомологичной ДНК протяженностью 6 т.п.н. (неповторяющаяся последовательность хромосомы II). Подобно другим случаям FB-вставок (в wc), этот аллель нестабилен, ревертирует с частотой от 10-2 до 10-3. Ревертанты к дикому типу возникают в результате утраты части DZL-вставки; обязательным является потеря центральной области длиной 6 т.п.н. Такая частичная эксцизия происходит, вероятно, в результате рекомбинации между FB-элементами, находящимися по концам вставки; ревертанты остаются нестабильными из-за присутствия FB-концов. Однако один FB-элемент в этом сайте не вызывает появления фенотипа DZL; поэтому наиболее вероятно, что за эффект трансвекции ответственна именно центральная последовательность протяженностью 6 т.п.н. Можно предположить, что эта область кодирует продукт, действующий в цис-положении. Весьма вероятно, что роль этого продукта заключается в узнавании контакта между ДНК.
Эффект трансвекции проявляется на значительных расстояниях. В качестве примера можно привести эффект мутации z на локус w, находящийся на расстоянии 0,75 единиц генетической карты правее этой мутации, что соответствует 300-400 т.п.н. Мутация z рецессивна. Она не проявляется у самцов (которые имеют только одну X-хромосому), но у самок, гомозиготных по z, репрессируется пара аллелей w+, находящихся в синапсисе, что обусловливает появление бледноокрашенных (желтых) глаз. Эффект исчезает, если один из аллелей w+ транслоцирован в другой участок или даже делетирован. Он может быть изменен определенными аллелями w, создаваемыми мутациями в правом сегменте локуса.
Характер взаимодействия между z и w позволяет предположить, что синапсис необходим для проявления эффекта, а не только, чтобы эффект распространялся дальше по аллелям, находящимся в состоянии синапсиса. Передача такого эффекта на большое расстояние показывает также, что он может быть обусловлен функциями различных локусов (z и w); следовательно, мутация DZL не обязательно должна являться составной частью самого локуса w, а может быть сцепленной с ним.
Скрещивание определенных линий D. melanogaster приводит к образованию потомства с «дисгенетическими признаками». Это выражается в появлении у них серии генетических дефектов, таких, как мутации, хромосомные аберрации, нарушение расхождения хромосом в мейозе и стерильность. Комплекс этих генетических аномалий характеризует явление, получившее название гибридного дисгенеза.
У D. melanogaster были идентифицированы две системы, обусловливающие гибридный дисгенез. Мухи, у которых функционирует первая система, разделены на типы I (inducer) и R (reactive). При скрещивании самцов I с самками R наблюдается уменьшение плодовитости, однако реципрокное скрещивание проходит нормально. Мухи со второй системой дисгенеза подразделяются на два типа, Р (paternal contributing) и М (maternal contributing). На рис. 37.8 продемонстрирована асимметрия системы: скрещивание между самцом Р и самкой М вызывает дисгенез, а в реципрокном скрещивании этого эффекта нет.
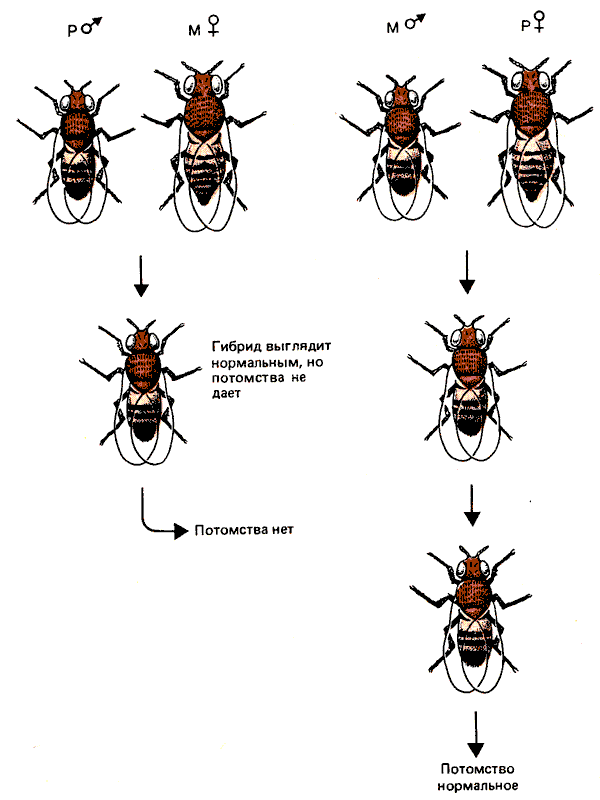
Рис. 37.8. Гибридный дисгенез асимметричен. Он индуцируется в скрещиваниях: самец Р х самка М; реципрокное скрещивание к дисгенезу не приводит.
Дисгенез преимущественно проявляется в зародышевых клетках. В скрещиваниях Р х М гибридные мухи F1 имеют нормальные соматические ткани, однако их гонады не развиваются. Морфологический дефект в развитии гаметы ведет начало от стадии, на которой в зародышевой линии начинается быстрое клеточное деление.
При скрещивании самца Р с самкой М индукцию дисгенеза способна вызвать любая из хромосом самца. Конструкция рекомбинантных хромосом показывает, что в пределах каждой Р-хромосомы есть области, способные вызывать дисгенез. Отсюда следует, что именно у самцов Р имеются факторы Р, расположенные в разных местах их хромосом. Локализация таких последовательностей в различных Р-линиях разная. Факторы Р отсутствуют в хромосомах мух М-типа.
Мухи М-типа вносят в явление дисгенеза другой вклад. Показано, что гибридный дисгенез проявляется только в том случае, если факторы Р подвергаются действию цитоплазмы, унаследованной по материнской М-линии. Материнский вклад назван М-цитотипом; его механизм непонятен, но, по-видимому, это не просто материнский эффект, поскольку он наблюдается в течение нескольких поколений. В тех редких линиях, которые удалось получить от скрещиваний самцов Р с самками М, факторы Р вызывали состояние, при котором они перестают быть активными. В процессе картирования ДНК мутантов w, обнаруженных среди дисгеничных гибридов, были выявлены те события, которые отвечают за индукцию мутаций при дисгенезе. Все мутации были обусловлены внедрениями ДНК в локус w. Три из четырех охарактеризованных внедрений Р-элемента обнаружены в одном и том же сайте (рис. 37.6). Внедрения Р стабильны, если хромосома находится в Р-цитотипе; если же она попадает в М-цитотип, эти последовательности вырезаются. Наряду с внедрениями Р в составе хромосом дисгеничных мух были обнаружены внедрения элементов copia. Одно из них обозначено на рисунке символом whd.
Р-элементы варьируют по длине, но последовательности нуклеотидов во всех случаях гомологичны. Разная длина обусловлена внутренними делециями в пределах Р-фактора, которые, по-видимому, происходят довольно часто. Самые длинные Р-элементы содержат около 2,9 т.п.н. и имеют прямые концевые повторы (см. рис. 37.2 и табл. 37.1). Существующая модель событий, приводящих к дисгенезу, основана на предположении, что интактные Р-факторы кодируют транспозазу, которая неактивна в Р-цитотипе, но становится активной в М-цитотипе. Некоторые короткие Р-элементы могут утратить способность синтезировать транспозазу, однако их активация в транс-положении возможна за счет активности фермента, кодируемого Р-элементом нормальной длины. Концы Р-фактора могут указывать, что они служат субстратом для ферментов транспозиции. Дисгеничные взаимодействия Р-М способны также активировать подвижность элементов copia (и других транспозирующихся элементов), однако эти элементы независимо от цитотипов, в которые попадает хромосома, далее остаются стабильными.
Гибридизация in situ позволила идентифицировать в каждом из Р-штаммов 30-50 копий Р-фактора; в штаммах М такие факторы не обнаружены. Хромосомы мух, полученных от скрещивания Р х М, содержат Р-факторы, внедренные во множество новых сайтов. Типичные для гибридного дисгенеза хромосомные разрывы происходят в горячих точках, которые и являются сайтами внедрений Р-фактора. Хотя частота транспозиции Р-факторов в хромосомы М у самцов и самок в потомстве дисгеничного скрещивания различна, в среднем она достигает порядка одного события на поколение. Хромосома, которая приобрела Р-элементы, становится дисгеничной, если она попадает в М-цитотип; ее способность индуцировать стерильность связана с числом приобретенных Р-элементов. С другой стороны, существуют данные, свидетельствующие о независимости процессов транспозиции и индукции стерильности: обнаружена линия Q, которая во всех отношениях аналогична линии Р, но не индуцирует в гибридах стерильности.
Линии D. melanogaster, которые были введены в лабораторную культуру более 30 лет назад, принадлежат к М-типу. Линии, ведущие свое начало от мух, пойманных в минувшие 10 лет, почти всегда относятся к типу Р. Значит ли это, что семейство Р-элементов распространилось в природных популяциях дрозофилы в последние годы? Р-элементы действительно отличаются высокой инвазивностью при введении в новую популяцию. Источником элемента должны служить другие виды мух. С другой стороны, показано, что Р-элементы могут утрачиваться популяцией, сохранявшейся в лабораторных условиях в течение большего промежутка времени.
Так как гибридный дисгенез подавляет скрещиваемость, его можно считать ступенью на пути видообразования. Допустим, что в какой-то географической зоне благодаря транспозирующемуся элементу возникла дисгеничная система. Другой элемент в другой зоне может привести к появлению другой системы. Если это определяет их стерильность при взаимных скрещиваниях, популяции становятся генетически изолированными и происходит дальнейшее отдаление. Следовательно, множественные дисгеничные системы могут привести к неспособности скрещиваться и к видообразованию.
Генетические исследования кукурузы, начатые в 1940 г., показали, что во время деления соматических клеток в геноме происходят определенные изменения. Эти изменения стимулируются контролирующими элементами, которые были обнаружены благодаря их способности перемещаться из одного сайта в другой. Внедрение контролирующего элемента в определенный сайт влияет и на активность смежных генов. Частота и синхронность событий, связанных с контролирующими элементами, регулируются в процессе развития; действия контролирующих элементов могут проявлять тканеспецифичность.
В настоящее время можно рассматривать контролирующие элементы как транспозоны. Их внедрение способно вызывать нестабильность аллеля в этом локусе. Такие аллели раньше называли изменчивыми (mutable); эта терминология еще сохранилась в виде символа m, используемого при описании таких аллелей. Утрата самого контролирующего элемента или его способности к транспозиции превращает изменчивый аллель в стабильный. В сайтах, где присутствуют контролирующие элементы, могут происходить делеции, дупликации, инверсии и транслокации, а также разрывы хромосом. Геном кукурузы содержит несколько семейств контролирующих элементов. Разные линии отличаются по количеству, типу элементов и сайтам их присутствия. Члены каждого семейства могут быть подразделены на два класса. Автономные элементы способны вырезаться и транспозироваться; их внедрение ведет к появлению нестабильных (m) аллелей. Неавтономные элементы теряют свою стабильность только в том случае, если в какой-то области генома присутствует автономный член того же семейства. Неавтономный элемент может комплементироваться в транс-положении автономным и осуществлять свойственные ему функции. Весьма вероятно, что неавтономные элементы произошли от автономных в результате утраты последними способности к транспозиции.
Автономные элементы подвержены «изменениям состояния», наследственным, но относительно нестабильным изменениям в их свойствах. Эти изменения способны влиять на периодичность и частоту транспозиции. Некоторые изменения приводят, по-видимому, к утрате автономным элементом его автономности. Некоторые повреждения, действующие в цис-положении неавтономных элементов, могут сделать их недоступными воздействию автономных. Таким образом, неавтономный элемент может стать надолго стабильным из-за того, что он не способен быть активированным к транспозиции. Нуклеотидные последовательности контролирующих элементов еще не установлены. Однако уже получены данные о характере взаимоотношений между автономными и неавтономными элементами. Так, известно, что неавтономные элементы могут быть активированы в транс-положении только определенными автономными элементами (вероятно, членами того же семейства). Данные о трех наиболее изученных семействах контролирующих элементов, Ac-Ds, Spm и Dt, суммированы на рис. 37.9.
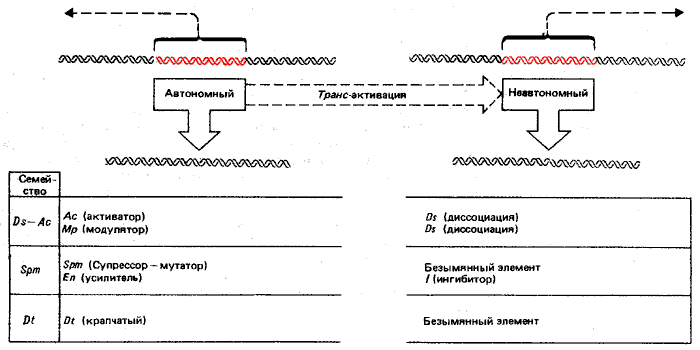
Рис. 37.9. Каждое семейство контролирующих элементов содержит как автономные, так и неавтономные члены. Автономные элементы способны к транспозициям и, кроме того, проявляют другие активности (например, влияют на экспрессию генов). Неавтономные элементы дефектны, по крайней мере в способности к транспозиции. Названия, первоначально присвоенные парам автономных и неавтономных элементов, классифицированы как семейства. Каждое семейство может включать более одного элемента; например, Spm-s и Spm-w представляют собой различные модификации Spm-элемента.
Функции контролирующих элементов могут быть идентифицированы с помощью мутаций. Например, два свойства представителей семейства Spm отражены в их названии: супрессор—мутатор. Их действие показано при введении Spm в определенный локус генома для активации неавтономного элемента. «Супрессор» подавляет выражение структурного гена в этом локусе. «Мутатор» проявляет способность транспозировать, в результате чего ген восстанавливает полную активность. Оба свойства принадлежат злементу, так как они переносятся вместе; однако обнаружены мутанты, фенотип которых свидетельствует о возможности их разделения. Поскольку способность неавтономного элемента супрессировать смежные функции контролируется автономным элементом в транс-положении, вряд ли этот эффект обусловлен только внедрением неавтономного элемента; вероятно, он должен иметь специфическую регуляторную основу.
Результаты транспозиционных событий удалось проследить благодаря двум свойствам кукурузы. Контролирующие элементы часто внедряются вблизи генов, которые проявляют видимый (но не летальный) эффект на фенотип. И, поскольку для кукурузы характерно клональное развитие, место и время транспозиционного события можно проследить (рис. 37.10). Природа события в данном случае не имеет значения: это может быть вставка, вырезание или (как показано на рисунке) хромосомный разрыв. Важно, что это событие происходит в гетерозиготе и изменяет экспрессию одного аллеля. (В следующем разделе рассматривается пример, когда разрыв приводит к утрате доминантных аллелей, что обусловливает рецессивный фенотип.) В результате потомки клетки, в которой произошло событие, определяемое присутствием элемента, приобретают новый фенотип, в то время как потомки клетки, которая не подвергалась изменениям, продолжают проявлять исходный фенотип.
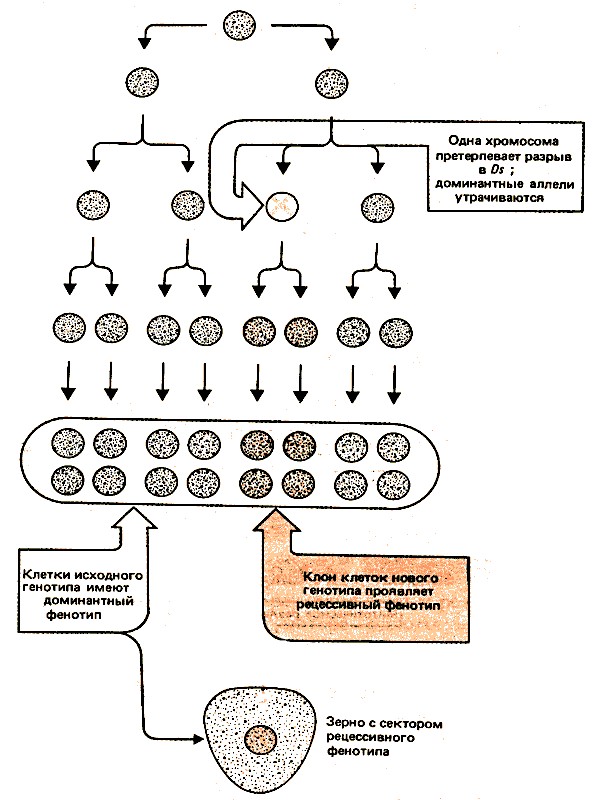
Рис. 37.10. С помощью клонального анализа можно идентифицировать группу клеток, ведущих происхождение от одной родительской клетки, у которой в результате транспозиционного события изменился фенотип. По числу измененных клеток судят, на какой стадии развития произошла транспозиция; локализация таких клеток указывает на тканевую специфичность эффекта.
Клетки, образующиеся в результате последовательных митотических делений одной исходной, расположены рядом и образуют сектор ткани. Изменения в фенотипе во время соматического развития получили название мозаицизма; он проявляется в виде секторов нового фенотипа, находящихся внутри ткани исходного фенотипа. Размер сектора зависит от числа делений клетки, дающей начало сектору; следовательно, размер зоны нового фенотипа определяется временем появления изменения в генотипе. Чем раньше оно произошло в клеточной родословной, тем большее число потомков образуется и, следовательно, больше размер пятна в зрелой ткани.
Присутствие неавтономного элемента Ds может иметь разные последствия для смежного локуса. При активации автономным Ac-элементом Ds-элемент может либо переместиться в новый сайт, либо вызвать хромосомный разрыв. Транспозиция сопровождается вырезанием из донорного сайта, в результате чего нестабильный аллель превращается в стабильный (но не обязательно дикого типа). Обратная связь между реверсией к стабильности и наличием хромосомного разрыва позволяет предполагать, что транспозиция и разрыв представляют собой альтернативные результаты активации Ds-элемента.
Пока Ds-элемент присутствует в локусе, он может влиять на уровень экспрессии гена; больше того, он способен изменять время экспрессии определенных генов в ходе развития. Кроме того, взаимодействие Ds-элемента со структурным геном влияет на структуру продукта этого гена.
Наиболее доступны для структурного анализа Ds-элементы, внедренные вблизи локуса Sh. Аллели Sh кодируют синтетазу сахарозы, отсутствие которой ведет к появлению фенотипа «морщинистого зерна», от которого и произошло название локуса. Была выделена мРНК синтетазы сахарозы протяженностью 3 т.п.н. С ее помощью удалось изолировать соответствующую геномную ДНК. Локусы sh-m, в которых присутствует Ds-элемент, отличаются рестрикционной картой в 5'-области гена, соответствующей внедрениям или перестройкам ДНК. Точная локализация изменений в последовательности неодинакова у различных аллелей sh-m.
Присутствие Ds-элемента изменяет экспрессию sh-m. У некоторых мутантов он почти не выражается. У других этот локус транскрибируется с образованием большого количества аберрантной РНК, которая короче, чем мРНК гена Sh, и состоит частично из последовательности Sh, а частично из новых последовательностей. В результате трансляции образуется белок, иммунологически родственный синтетазе сахарозы, но имеющий измененную электрофоретическую подвижность. После того как станет известной структура локусов Sh и sh-m, появится возможность и ответить на вопрос: какие именно сайты в пределах структурного гена или вблизи него подвержены влиянию Ds-элемента и как это сказывается на выражении гена?
Локус Waxy (wx) определяет содержание амилозы в пыльце и ткани эндосперма. Он кодирует фермент UDP глюкозу-крахмал—глюкозилтрансферазу с мол. массой 58000 дальтон, который связывается гранулами крахмала. Обнаружены внедрения в этот локус Ас- и Ds-элементов. Сравнивая последовательности этих вставок с последовательностями вставок в локус Sh, нам удалось определить структуру Ас- и Ds-элементов. Она представлена на рис. 37.11.
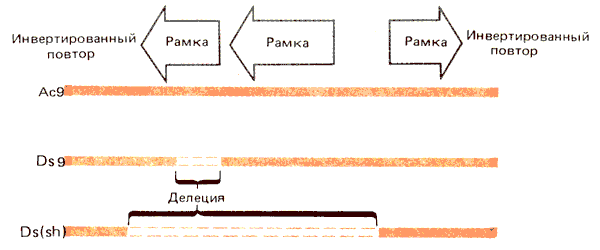
Рис. 37.11. Ac-элементы содержат три открытые рамки считывания; Ds-элементы имеют внутренние делеции.
Автономный Ас-элемент содержит 4563 пары оснований и включает три основные открытые рамки считывания. Рамки 1 и 2 считываются в одном и том же направлении и, судя по составу триплетов, кодируют белки. Функция рамки 3, которая считывается в противоположном направлении, неясна.
Рамки считывания составляют большую часть последовательности Ас-элемента. На его концах имеются инвертированные повторы из 11 п.н.; в сайте внедрения дуплицируется последовательность мишени из 8 п. н.
Последовательности Ds-элементов варьируют как по длине, так и по составу. Однако между ними и Ас-элементами есть родство: они содержат на концах те же инвертированные повторы из 11 п.н. Элемент Ds9 имеет в рамке считывания 1 делецию протяженностью 194 п. н. Элемент Ds6 имеет протяженность, равную 2 т.п.н., соответствующую 1 т.п.н. с каждого конца Ас-элемента, поэтому основная часть рамок 1 и 2 отсутствует. Сложный двойной Ds-элемент содержит последовательность, представленную одним Ds6-элементом, внедренным в обратной ориентации в другой.
Неавтономные элементы по-видимому могут иметь разную форму, однако во всех случаях для них характерна утрата некоторых внутренних последовательностей при сохранении терминальных инвертированных повторов (и возможно каких-то других особенностей организации). Структура неавтономных элементов согласуется с общим представлением об их происхождении из автономных в результате делеции. По-видимому, такие делеции обусловливают инактивацию транс-активной транспозазы; при этом сайты, на которые действует транспозаза, сохраняются. Таким образом, Ds-элементы в чем-то напоминают дефектные Р-элементы D. melanogaster.
Первоначально Ds-элемент был идентифицирован благодаря его способности обеспечивать сайт хромосомного разрыва при активации регулятором Ас. Последствия такой активации показаны на рис. 37.12. Рассмотрим гетерозиготу, в которой Ds-элемент расположен на одном из гомологов между центромерой и серией доминантных маркеров (CI, Bz, Wx), эффекты которых могут быть прослежены по цвету клеток или при соответствующем окрашивании. (CI представляет собой регулятор, который вызывает обесцвечивание алейрона; Bz гликозилирует антоцианиновые пигменты; Wx обусловливает образование крахмала, окрашивающегося синим при добавлении I2-КI. Другой гомолог утрачивает Ds и содержит рецессивные маркеры ( С, bz, wx). Разрыв в локусе Ds ведет к появлению ацентрического фрагмента, несущего доминантные маркеры. Из-за отсутствия центромеры этот фрагмент теряется во время митоза. В результате клетки потомков имеют только рецессивные маркеры, находящиеся на интактной хромосоме. Возникает ситуация, изображенная на рис. 37.11.
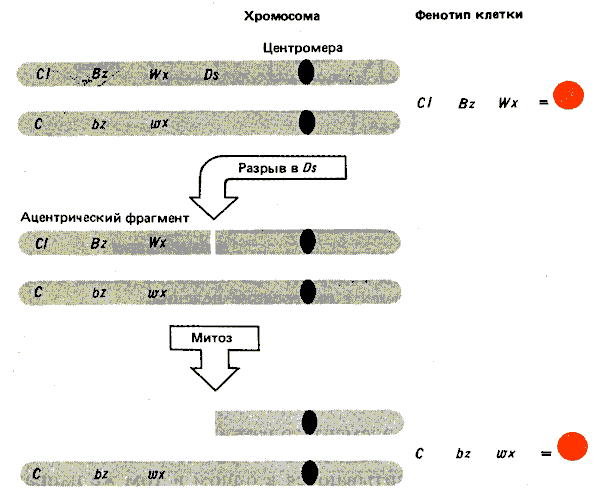
Рис. 37.12. Разрыв в контролирующем элементе ведет к утрате ацентрического фрагмента. Если фрагмент несет доминантные маркеры гетерозиготы, его утрата обусловливает изменение фенотипа.
Разрыв в локусе Ds ведет к образованию двух необычных хромосом. Они возникают при соединении разорванных концов продуктов репликации. Одна из них представлена U-образным ацентричным фрагментом, состоящим из соединенных сестринских хроматид, в области, расположенной дистальнее Ds-элемента (на рис. 37.12 изображены слева). Другая является U-образной дицентричной хромосомой, состоящей из сестринских хроматид, проксимальных по отношению к Ds (на рисунке изображены справа). Последняя структура ведет к возникновению классического цикла разрыв—слияние—мост, изображенного на рис. 37.13.
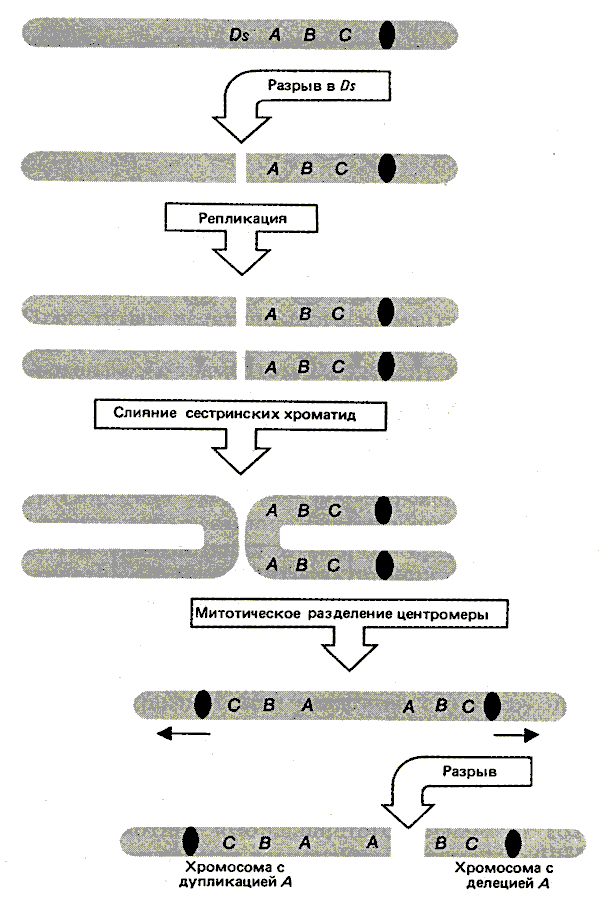
Рис 37.13. Ds-элемент обеспечивает сайт, в котором инициируется цикл разрыв—слияние—мост (при активации Ас-элементом). Клональный анализ дает возможность анализировать последствия этого цикла.
Рассмотрим судьбу хромосомы-дицентрика в митозе. Наличие двух центромер приводит к тому, что она растягивается к противоположным полюсам. Напряжение разрывает эту хромосому в случайном сайте между центромерами. На примере, приведенном на рис. 37.13, разрыв происходит между локусами A и B, в результате чего одна из дочерних хромосом содержит дупликацию A, а другая - делецию. В случае доминантности маркера A клетки с дупликацией будут сохранять фенотип A, а клетки с делецией - проявлять рецессивный фенотип a.
Цикл разрыв—слияние—мост продолжается в течение дальнейших клеточных поколений, что обеспечивает сохранение генетических изменений у потомков. Для примера рассмотрим хромосому, утратившую маркер A в результате деления. В следующем цикле разрыв может произойти между B и C; часть потомства в этом случае будет нести дупликацию маркера B, а другая - делецию. Последовательные потери доминантных маркеров могут быть прослежены по появлению в пределах секторов субсекторов.
Мы уже упоминали, что транспозиция Ds-элемента обычно сопровождается его исчезновением из донорного сайта, что отличает этот эффект от транспозиции у бактерий. Результаты клонального анализа свидетельствуют о том, что транспозиция Ds-элемента почти всегда происходит после того, как донорный элемент реплицировался. Больше всего данных получено при изучении транспозиций из донорного в реципиентный сайт в пределах одной и той же хромосомы. Такие исследования были проведены с элементом Мр, относящимся к Ac-типу.
В зависимости от того, произошла ли репликация реципиентного сайта, различают два возможных результата транспозиции (рис. 37.14). Если реципиентный сайт не реплицировался перед транспозицией, элемент будет реплицирован в своем новом сайте. В этом случае он присутствует в реципиентном сайте на обеих дочерних хромосомах. Если же реципиентный сайт был предварительно реплицирован, то изменена в реципиентном локусе будет только та хроматида, которая физически приобрела элемент. В любом случае элемент утрачивается из донорного сайта одной хроматиды и остается в донорном сайте другой.
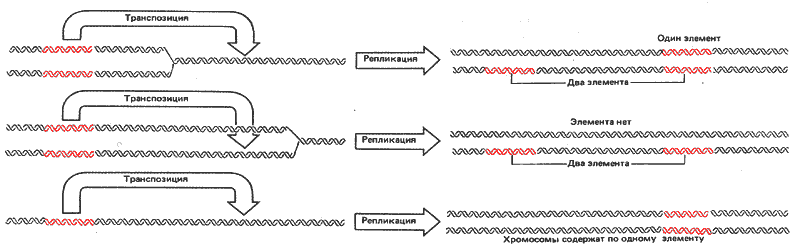
Рис. 37.14. Транспозиция у кукурузы заключается в перемещении элемента из донорного сайта после его репликации; природа продуктов зависит от того, произошла ли до транспозиции репликация реципиентного сайта.
Вверху: если реципиентный сайт не реплицирован, элемент дуплицируется после транспозиции, в результате чего каждая дочерняя хромосома приобретает элемент. Только одна из дочерних хромосом не содержит его в исходном сайте. У этой хромосомы элемент локализуется в реципиентном сайте, в то время как другая дочерняя хромосома содержит его как в донорном, так и в реципиентном сайтах.
В центре: если реципиентный сайт был реплицирован, только одна дочерняя хромосома приобретает элемент в этом сайте. Обычно элемент перемещается из донорного сайта, находящегося на одной хроматиде, в реципиентный сайт, находящийся на другой хроматиде, в результате в генотипе обеих хроматид происходят изменения. (Если элемент перемещается в реципиентный сайт, находящийся на той же хроматиде, генетические последствия будут аналогичны представленным в нижней части рисунка.)
Внизу: если бы транспозиция происходила перед репликацией донорного сайта, обе дочерние хромосомы содержали бы элемент в реципиентном сайте.
На рис. 37.14 (два верхних ряда) представлена ситуация, когда деление клетки ведет к образованию дочерних особей, генотипы которых отличаются друг от друга и от генотипа родительской клетки. Клональный анализ обнаруживает потомков этих клеток в виде сдвоенных секторов: появление сектора одного нового генотипа сопровождается появлением другого сектора, представляющего другой генотип. Заметим, что сдвоенные сектора представляют собой неизбежный результат транспозиции в нереплицировавшийся реципиентный сайт. Если реципиентный сайт уже реплицировался, они возникают только в том случае, когда мишень находится в противоположной по сравнению с донорной хроматиде. Преобладание именно сдвоенных секторов (80% от всех транспозиций у кукурузы) свидетельствует, что у этого растения такие события можно считать обычными. Сравнительно небольшое число транспозиций, ведущих к появлению единичных секторов, может быть обусловлено либо расположением и донорных и реципиентных сайтов на одной хроматиде, либо тем, что такие транспозиции не связаны с репликацией (рис. 37.14, нижний ряд). Возникновение единичного сектора может быть и результатом артефакта, например при потере одного из продуктов транспозиции. Хотя транспозиция обычно все-таки связана с репликацией донорного сайта, мы не знаем, насколько эта связь обязательна.
Дрожжевые клетки S. cerevisiae могут успешно размножаться как в гаплоидном, так и в диплоидном состоянии. Переход из одного состояния в другое имеет место при скрещивании (слияние гаплоидных спор с образованием диплоидов) и при споруляции (мейоз в диплоидах дает гаплоидные споры). Способность осуществлять эти действия определяется типом спаривания штамма. Свойства штаммов, относящихся к разным типам спаривания, суммированы в табл. 37.2. Следует иметь в виду, что скрещивание возможно, если гаплоиды принадлежат к различным генетическим типам спаривания, а споруляция происходит, если диплоиды представляют собой гетерозиготы и, следовательно, способны образовывать рекомбинанты.

Таблмца 37.2. Тип спаривания контролирует несколько активностей
Два типа спаривания определяются аллелями МАТa и МАТa, локуса типа спаривания. Гаплоидные клетки должны иметь генотип МАТa, или МАТa. Спариваться могут только клетки противоположного типа. Клетки дрожжей выделяют феромоны; благодаря этому происходит узнавание клеток противоположного типа спаривания. Клетки МАТa выделяют небольшой полипептид-фактор а; клетки МАТa выделяют фактор а. Каждый фактор действует на клетки противоположного типа спаривания, чтобы координировать слияние клеток и ядер. Хотя обычно мы имеем дело со спариванием гаплоидных клеток, гомозиготные диплоиды (МАТa/МАТa или МАТa./МАТa) ведут себя подобно гаплоидам и способны спариваться с клетками противоположного типа.
Гомозиготные диплоиды не способны спорулировать. С другой стороны, диплоиды типа МАТa/МАТa, образуемые при спаривании гаплоидов, способны спорулировать. На рис. 37.15 показано, каким образом сохраняется у дрожжей нормальный жизенный цикл, включающий чередование стадий гаплоид/диплоид. Существуют и другие различия между гетерозиготами и гомозиготами в характере почкования (отделения дочерних клеток), чувствительности к облучению и некоторых функциях клеточного цикла. Так как гетерозигота фенотипически отличается от гомозиготы, МАТa и МАТa. можно считать ко доминантными аллелями: каждый из них детерминирует свой собственный продукт, и ни один из этих продуктов не является дефектным вариантом другого.
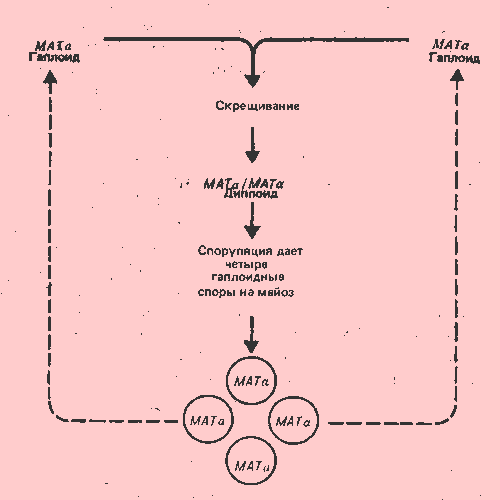
Рис. 37.15. Жизненный цикл дрожжей включает спаривание гаплоидов МАТa и МАТa, ведущее к образованию гетерозиготных диплоидов, которые при споруляции образуют гаплоидные споры.
Некоторые штаммы дрожжей способны менять (переключать) тип спаривания. Благодаря этому удалось расшифровать механизм генетического контроля типов спаривания у дрожжей. Такие гомоталличныештаммы несут доминантный аллель НО и меняют свой тип спаривания часто (один раз на каждое поколение). Гетероталличные штаммы с рецессивным аллелем ho имеют стабильный тип спаривания, подвергающийся изменению с частотой примерно 10-5.
Экспрессия гена НО находится под контролем типа спаривания, так как он не функционирует в диплоидах МАТa/МАТa. По-видимому, в этом случае переключения не требуется, поскольку и так оба аллеля МАТ экспрессируются. В присутствии гена НО в популяции дрожжей (независимо от первоначального типа спаривания) после нескольких генераций появляется большое число клеток обоих типов, в результате чего образуются диплоиды МАТa/МАТa, которые начинают преобладать в популяции. Образование стабильных диплоидов в гаплоидной популяции может рассматриваться как смысл переключения.
Существование переключения позволяет предполагать, что все клетки содержат информацию, необходимую для экспрессии обоих типов спаривания, но выражают только один. Это заключение подтверждается анализом мутаций в каждом типе МАТ-аллеля. Переключение в штаммах НО обусловливает замену мутантного аллеля либо локусом типа МАТa, либо МАТa.
Откуда появляется генетическая информация для экспрессии дикого типа? Переключение требует два дополнительных локуса. Чтобы образовался МАТa-тип, необходим локус HMLa; для образования МАТa-типа при переключении необходим Локус HMRa. Эти локусы локализованы в одной хромосоме с геном МАТ, однако удалены от него на значительное расстояние; HML находится слева, a HMR-справа от него.
Кассетная модель переключения типа спаривания основана на предположении, что локус МАТ содержит активную кассету а- или a-типа. HML и HMR содержат молчащие кассеты, которые в процессе переключения замещают кассету в МАТ-локусе. Обычно HML содержит кассету a, a HMR-кассету a. В кассетах заключена генетическая информация, способная транспозироваться.
Процесс переключения иллюстрирован на рис. 37.16. Событие переключения не является реципрокным, так как копия HML или HMR замещает аллель в локусе МАТ. Это стало известно благодаря тому, что при переключении мутация в МАТ утрачивается навсегда, она не обменивается с копией, которая замещает ее.
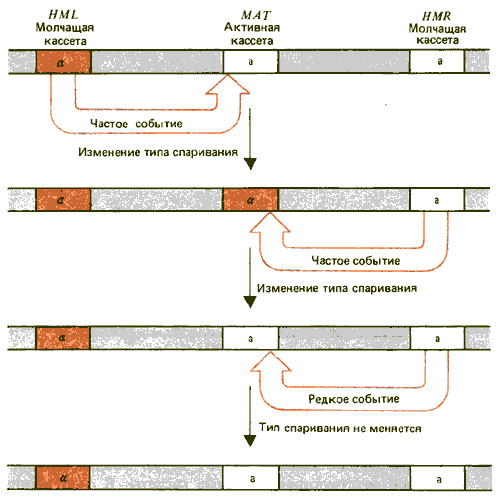
Рис. 37.16. Изменение типа спаривания происходит в результате замещения активных кассет молчащими кассетами противоположного генотипа; если транспозиция осуществляется между кассетами одного и того же типа, тип спаривания не меняется.
Копии, присутствующие в молчащих кассетах HML или HMR, также могут быть мутантными. В этом случае переключение перебрасывает мутантный аллель в локус МАТ. Мутантная копия сохраняется в HML или HMR в течение неопределенного числа переключений. Эти события очень напоминают транспозицию, при которой донорный элемент копируется, копия встраивается в реципиентный сайт, в то время как сам элемент сохраняется неповрежденным. Переключение типа спаривания соответствует направленной транспозиции, так как существует только один реципиент (МАТ) и два донора (HML и HMR).
Как показано на рис. 37.16, при переключении происходит замещение МАТa копией HMLa или замещение МАТa копией HMRa. Однако данные, полученные на мутантных локусах, показывают, что иногда HMLa замещает МАТa, a HMRa-МАТa. Если локусы не маркированы, такие переключения проходят незамеченными. В 80-90% переключений аллель МАТ замещается аллелем противоположного типа. Эффект замещения определяется фенотипом клетки. Клетки фенотипа а в качестве донора предпочтительно выбирают HML; клетки фенотипа a предпочитают HMR. Можно получить дрожжевые штаммы, у которых обычная ориентация молчащих кассет изменена на обратную. Если их генотипы представлены локусами HMLa и HMRa, 92% переключений будут гомологичными, так как выбор доноров остается неизмененным.
Интересной особенностью события переключения является его зависимость от происхождения клетки. Переключение определяется только в продуктах деления: обе дочерние клетки имеют один и тот же тип спаривания, отличный от типа спаривания родительской клетки. Можно предположить, что переключение происходит перед тем, как локус МАТ реплицируется. (Сравните эту ситуацию с существующей зависимостью между транспозицией и репликацией у кукурузы, показанной на рис. 37.14).
Как молчащие, так и активные локусы типов спаривания были клонированы в плазмидах, реплицирующихся в дрожжевых клетках. Структура генов представлена на рис. 37.17. Каждый тип аллеля содержит отличающуюся область, обозначенную Ya или Ya. Эта область с двух сторон фланкирована участками X и Z1, которые практически идентичны во всех кассетах. (Идентифицированы только четыре различия, каждое из которых обусловлено точечной мутацией.) Более отдаленные фланкирующие области W и Z2 одинаковы в HML и МАТ, однако в HMR они отсутствуют. (Организация одинаковая и не зависит от ориентации аллелей а и a.)
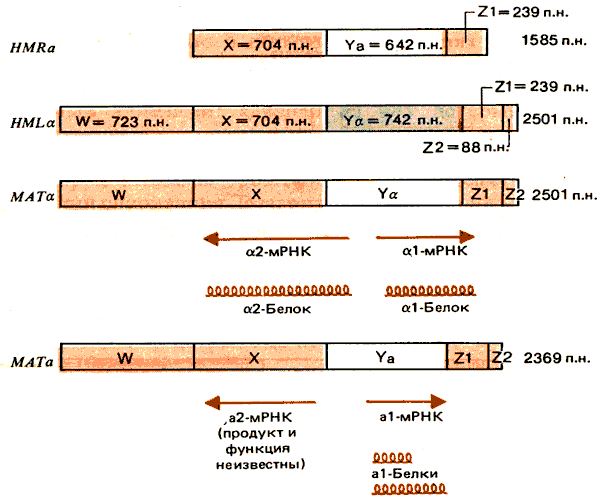
Рис. 37.17. Молчащие кассеты имеют те же последовательности, что и соответствующие активные кассеты. В а- и a-типах изменена только область Y. В HMRотсутствуют общие для HMLи МАТ последовательности W и Z2.
Мутации в МАТa можно отнести к двум группам комплементации (a1 и a2), в то время как мутации в МАТa попадают в одну группу (a1). Способность плазмид, несущих кассеты, комплементировать мутантные локусы в МАТ позволяет приравнять отдельные области каждого локуса к комплементационным группам. Взаимосвязь между комплементационными группами и транскриптами, соответствующими МАТ-аллелям, показана на рис. 37.17. Следует указать, что белки еще не охарактеризованы и данные о них получены только благодаря анализу кодирующих последовательностей.
Комплементационная группа a1 соответствует транскрипту a1, который кодируется полностью в пределах области Ya, и поэтому является уникальным для локуса а-типа. Последовательность a1 кодирует два потенциальных продукта. Более короткий терминирует в кодоне UGA; однако нам известно, что может происходить считывание информации и за терминирующим кодоном, поскольку мутации, следующие за ним предотвращают проявление функции a1. Мы не знаем, выполняет ли более короткий белок функцию, отличающуюся от функции более длинного белка. Для a2-транскрипта функция не была определена. Его транскрипция осуществляется с промотора, который, по крайней мере частично, находится в области Ya. Транскрипт расположен в пределах общей для МАТa и МАТa области X и может быть транслирован с образованием любого из двух коротких полипептидов. Каждый из транскриптов, образуемых в локусе МАТa, соответствует одной из известных групп комплементации. Транскрипты инициируются дивергентно в пределах Ya, и каждый распространяется в прилегающую общую область (X и Z1). Транскрипт a1 кодирует белок, основная часть которого кодируется областью Ya. Транскрипт a2 может транслироваться областью Ya. Транскрипт a2 может транслироваться с инициирующего кодона, расположенного в области Ya, но большая часть последовательности соответствует области X.
Вывод о функциях продуктов сделан на основе результатов изучения мутантов из каждой группы комплементации. Эти данные представлены на рис. 37.18. У гаплоидов функции спаривания а выражаются конститутивно. Для индуцирования споруляции необходимы функции a1 и a2. Группа a2 также ответственна за репрессирование функций спаривания типа а у гаплоидов. Продукт a1 индуцирует у гаплоидов функции a-типа спаривания.
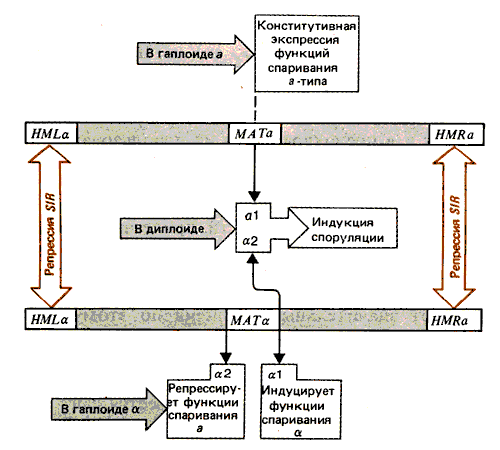
Рис. 37.18. Для индукции споруляции в диплоидах функции al и a2 кооперируются. У гаплоидов функция a2 репрессирует функции спаривания; a1 индуцирует функции спаривания типа a.
Рассматривая карту транскрипции, представленную на рис. 37.17, можно обнаружить интересный факт. Транскрипция как МАТa, так и МАТa. инициируется в пределах области Y. Экспрессируется только МАТ-локус; в то же время область Y представлена в соответствующих нетранскрибируемых кассетах, HML или HMR. Следовательно, регуляция экспрессии не осуществляется посредством прямого узнавания какого-то сайта, перекрывающегося с промотором. Отличать HML HMR от МАТ должен сайт, находящийся вне кассет.
Можно ли определить способ контроля активности кассет путем идентификации других локусов, которые влияют на кассеты? Такие локусы были обнаружены при изучении мутаций, предотвращающих выражение аллеля, занимающего МАТ. Другие мутации обусловливают экспрессию обычно молчащих кассет в HML HMR. (Если экспрессируются обе функции, а и a, клетки ведут себя как гетерозиготные диплоиды.) Были идентифицированы четыре группы комплементации, мутации в которых ведут к выражению HML
Различные активности молчащих и активных кассет могут зависеть от структуры хроматина. Использование зондов, представляющих области, прилегающие к каждой из кассет, позволяет определить структуру хроматина с помощью метода концевого мечения. Все кассеты содержат сайты, сверхчувствительные к ДНКазе I, однако существуют значительные различия по этому признаку между молчащими и активными кассетами. Локализация чувствительных сайтов показана на рис. 37.19.
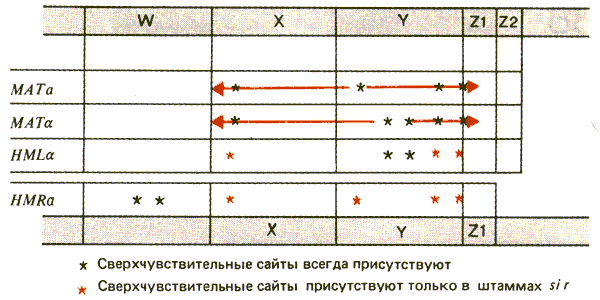
Рис. 37.19. Большинство сайтов, сверхчувствительных к ДНКазе I, которые обнаружены в локусе МАТ, не присутствуют в HML или HMR; однако в мутантах sir- они активируются. Некоторые постоянные сверхчувствительные сайты найдены в областях, фланкирующих HML и HMR.
Общий характер сверхчувствительности одинаков у МАТa и МАТa. В каждом случае имеется сайт в З'-конце левостороннего транскрипта (a2 или a2). В области между двумя транскриптами имеется либо единичный (a), либо сдвоенный (a) сайт. Кроме того, пара сверхчувствительных сайтов есть вблизи границы Y—Z.
Все эти сайты отсутствуют в HML и HMR, за исключением пары между a1 и a2. Однако введение мутации sir- восстанавливает все утраченные сайты сверхчувствительности. Следовательно, активация кассет связана с присутствием сверхчувствительных сайтов. Можно предположить, что разные сайты имеют различные функции. Например, сайты в пределах Y могут быть необходимым (хотя и недостаточным) фактором для инициации транскрипции. Функция сайтов в пределах X неизвестна. Пара сайтов на границе Y—Z может быть важна для инициации события транспозиции (см. следующий раздел).
Некоторые сайты обнаружены во фланкирующей ДНК вблизи HML и HMR. Их присутствие не зависит от функции SIR; именно эти сайты помогли идентифицировать молчащие кассеты как мишени для действия SIR. Делеционное картирование показывает, что фланкирующий сайт слева от HMLочень важен для ответа на действие SIR; фланкирующий сайт справа также имеет значение. Узнавание этих сайтов должно каким-то неизвестным способом быть передано в пределы кассет для предотвращения образования сверхчувствительных сайтов. Вместо этого различные сверхчувствительные сайты позволяют локусу экспрессироваться и быть подвергнутым переключению.
Каким образом функция локуса sir проявляется на расстоянии? Одной из возможностей является передача структурного эффекта по длине ДНК. Например, степень суперспирализации может оказывать влияние на сайты внутри кассет или же доступность сайта может определяться состоянием нуклеосомы.
В популяциях, подвергающихся переключениям, рекомбинация между МАТ и HML(или HMR) происходит с низкой частотой. Можно предположить, что процесс переключения включает спаривание между локусом МАТ и одной из молчащих кассет. Обычным следствием этого взаимодействия является переключение типа спаривания, однако иногда вместо этого происходит реципрокная рекомбинация. Рекомбинационное событие, по существу, сливает рекомбинирующие локусы и вырезает материал между ними. Это указывает на то, что все три кассеты ориентированы на хромосоме одинаково.
Сайты, необходимые для транспозиции, могут быть идентифицированы с помощью мутаций, предотвращающих переключение. Делеции в правом конце области Y не проявляют какого-либо эффекта до тех пор, пока они не переходят границу области Z1; делеции в этом участке приводят к утрате способности переключения. Действующие в цис-положении точечные мутации, названные inc (от англ, inconvertable), были найдены как в МАТa, так и в МАТa,. Они возникают в результате замещения пар оснований в области Z1, вблизи от границы с областью Y. В редких случаях, когда переключение все же происходит, мутация в МАТ утрачивается, что свидетельствует о ее локализации в замещаемой области. Мутации, относящиеся к другому классу (stk), сохраняются после события переключения, так что, по-видимому, они лежат вне области, которая подвергается замещению. Следовательно, замещение локуса МАТ включает сайт вблизи границы Y—Z1 и для переключения совершенно необходимы последовательности как внутри, так и вне замещаемой области. Доказательством однонаправленности процесса можно считать отсутствие таких мутаций в HML и HMR, которые предотвращают переключение; кроме того, если мутации inc перенесены в молчащие кассеты, они не предотвращают переключение. В действительности они эффективно транспозируются в локус МАТ, после чего мутация inc снова проявляет свой эффект.
Граница области Y—Z представляет собой сайт изменения ДНК, которое может быть связано с транспозицией. В клетках, подвергающихся переключению, 1-3% ДНК локуса МАТ содержат двухцепочечный разрез именно в этом сайте. Разрез находится в пределах 10 пар оснований пограничной области и совпадает с сайтом сверхчувствительности к ДНКазе.
Рассмотрим предполагаемую серию событий, происходящих при переключении. Для этой цели может быть пригодным сверхчувствительный сайт на границе Y—Z1 области МАТ-локуса, так как он отсутствует в нуклеосоме. Его узнает эндонуклеаза, контролируемая локусом НО. Возможно, сверхчувствительность к ДНКазе I in vitro отражает природную чувствительность к эндонуклеазе НО in vivo!
Эндонуклеаза НО, называемая также YZ-эндонуклеазой, вносит ступенчатый разрез в области Z1, находящейся на расстоянии трех пар оснований от сайта связывания YZ. Она не разрезает мутантные локусы МАТ, которые не способны переключаться. Последовательности, содержащие менее 11 пар оснований мишени после делетирования, также не разрезаются, что свидетельствует об относительно большой протяженности сайта узнавания нуклеазой. Вероятно он не встречается ни в одном другом участке генома.
Синтез эндонуклеазы НО находится под контролем клеточного цикла. Время ее образования может объяснять характер переключения. Ген выражается только в течение фазы G1 материнской клетки, и это объясняет почему оба ее потомка имеют новый тип спаривания.
На рис. 37.20 схематически изображена реакция в отношении одиночных цепей. (Естественно, что в случае двухцепочечной ДНК события значительно сложнее.) Допустим, что свободный конец Z локуса МАТ атакует либо HML-, либо HMR-локус и спаривается с областью Z. Область Y локуса МАТ деградирует до тех пор, пока не открывается участок, гомологичный области X. Затем локус МАТ спаривается с HML или HMR как в левой (X), так и правой (Z1) части. Область Y локусов HML или HMRкопируется, чтобы заместить утраченный участок МАТ-локуса (который может простираться за пределы области Y). Спаренные локусы расходятся. (Порядок событий может быть другим.) Стадии, следующие за первоначальным разрезом, требуют участия ферментов, осуществляющих общую рекомбинацию. Отметим две особенности этого процесса. В отличие от других событий транспозиции переключение предполагает спаривание в обоих концах транспозируемого сегмента, деградацию и замещение промежуточного материала. Процесс инициируется в МАТ-локусе, который должен быть замещен. В этом смысле описание HML и HMRкак донорных локусов относится к их основной роли, но не к механизму процесса, который является обратным по отношению к обычной инициации транспозиции донором. В последовательностях этих локусов не идентифицированы какие-либо короткие прямые повторы. По-видимому, в данном случае механизм объединения не включает использование ступенчатых разрезов, обнаруженных для других транспозиционных событий.
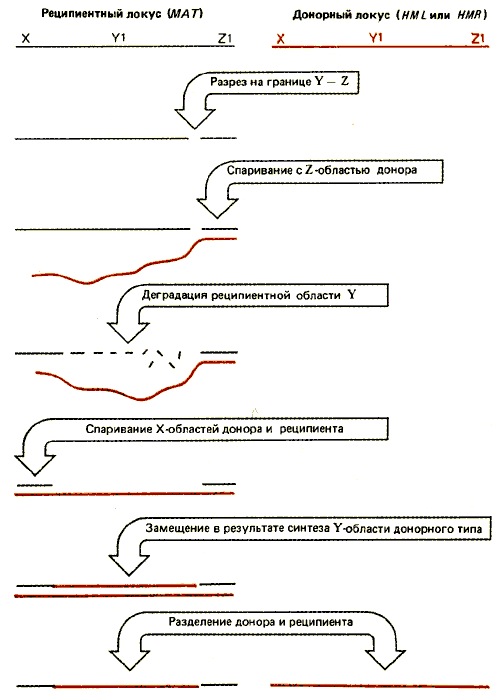
Рис. 37.20. Замещение кассеты инициируется реципиентным локусом и заключается в спаривании с донорным локусом областей, расположенных по обе стороны от области Y. Последовательность, которая удаляется и замещается, может захватывать область X. На рисунке показана реакция, происходящая на отдельных цепях реципиентной и донорной молекул; на самом деле процесс происходит в двухцепочечных областях ДНК.
Эукариотичеекие транспозирующиеся элементы детально рассмотрены в сб. «Mobile Genetic Elements» (ed. Shapiro, Academic Press, New York, 1983). Особый интерес представляют главы, в которых обсуждаются Ту-элементы дрожжей, транспозоны D. melanogaster, рассматриваются данные картирования локуса white. Заслуживают внимания сведения о молекулярной структуре контролирующих элементов кукурузы. В сборнике представлен исчерпывающий обзор о типах спаривания у дрожжей.